
【题目】环境监测显示,某地市的主要气体污染物为SO2,NOx,CO等,其主要来源为燃煤、机动车尾气。进行如下研究:
(1)为减少燃煤对SO2的排放,可将煤转化为清洁燃料水煤气(CO和H2)。
已知:H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ/mol
C(s)+1/2O2(g)=CO(g)△H=-110.5kJ/mol
写出焦炭与水蒸气反应的热化学方程式______;
(2)汽车尾气中NO是在发动机气缸中生成的,反成为:N 2(g)+O 2(g) ![]() 2NO(g) △H>0
2NO(g) △H>0
①将含0.8 mol N2和0.2molO2(近似空气组成)的混合气体充入某密闭容器中,保持1300℃反应达到平衡,测得生成8×10-4molNO 。计算该温度下此反应的化学平衡常数K=_______(填近似计算结果)。
②汽车启动后,汽缸内温度越高,单位时问内NO排放最越大,原因是______________。
(3)利用如图所示装置(电极均为惰性电极)可吸收SO2,并利用阴极排出的溶液吸收NO2。

①电极A的电极反应式为________________;电极B的电极反应式为_____________。
②碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时生成SO32-。该反应的离子方程式为_______________。
【答案】 C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3 kJ.mol-l 4×10-6 温度升高,反应速率加快且平衡正向移动 SO2+2H2O-2e-=SO42-+4H+ 2HSO3-+2H++2e- =S2O42-+2H2O 4S2O42-+2NO2+8OH- =8SO32-+ N2+4H2O
【解析】(1)①已知:ⅠH2(g)+![]() O2(g)=H2O(g)△H=-241.8KJ/mol,ⅡC(s)+
O2(g)=H2O(g)△H=-241.8KJ/mol,ⅡC(s)+![]() O2(g)=CO(g)△H=-110.5KJ/mol,利用盖斯定律计算反应热,将Ⅱ-Ⅰ可得C(s)+H2O(g)=CO(g)+H2(g)H=+131.3KJ/mol;
O2(g)=CO(g)△H=-110.5KJ/mol,利用盖斯定律计算反应热,将Ⅱ-Ⅰ可得C(s)+H2O(g)=CO(g)+H2(g)H=+131.3KJ/mol;
(2)①已知气缸中生成NO的反应为:N2(g)+O2(g)2NO(g)△H>0.若气缸中进入1mol空气(1mol空气含有0.8molN2和0.2molO2),1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol,反应前后气体物质的量相同,计算平衡常数时可以用物质的量代替平衡浓度计算,先计算物质的平衡量,N2为0.8mol-4×10-4 mol,O2为0.2mol-4×10-4 mol,带入平衡常数表达式即可,书写计算得K=![]() =4×10-6;
=4×10-6;
②气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移;
(3)①依据图示可知,阳极A电极上SO2发生氧化反应,电极反应式为SO2+2H2O-2e-=SO42-+4H+;阴极B电极上HSO3-得电子生成S2O42-,阴极区发生反应2HSO3-+2H++2e-=S2O42-+2H2O;
②阴极排出的溶液为S2O42-,二氧化氮与其发生反应,S2O42-中硫元素由+3价,变为硫酸根中硫元素为+4价,S2O42-被氧化是还原剂;二氧化氮中的氮元素化合价为+4价变为氮气0价,二氧化氮被还原为氧化剂,依据原子守恒和得失电子守恒可得,发生的离子方程式为4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如下图所示),每辆“纳米车”是由一个有机分子和4个C60分子构成。 “纳米车”可以用来运输单个的有机分子。下列说法正确的是

A. 人们用肉眼可以清晰看到“纳米车”的运动
B. “纳米车”的诞生说明人类操纵分子的技术进入了一个新阶段
C. C60是一种新型的化合物
D. C60与金刚石互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在呈酸性的无色溶液中大量共存的是( )
A.Ba2+、Na+、NO3﹣、MnO4﹣
B.Mg2+、Cl﹣、Al3+、SO42﹣
C.K+、OH﹣、HCO3﹣、NO3﹣
D.Ca2+、Na+、Fe3+、SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶胞的叙述,正确的是( )
A. 晶胞的结构是晶体的结构B. 不同的晶体中晶胞的大小和形状都相同
C. 晶胞中的任何一个粒子都属于该晶胞D. 已知晶胞的组成就可推知晶体的组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于醇的物理性质的描述,不适合用氢键的形成去解释的是
A. 相对分子质量相近的醇和烷烃,前者的沸点高于后者
B. 饱和一元醇,所含的碳原子数目越多,沸点越高
C. 醇的碳原子和支链数目均相同时,含羟基数越多,沸点越高
D. 甲醇、乙醇、丙醇、乙二醇、丙三醇可与水任意比互溶,彼此也互溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. 碳酸氢钠与盐酸反应:CO32-+2H+=CO2↑+H2O
B. 次氯酸钙溶液中通入过量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C. 二氧化锰与浓盐酸共热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D. 钠与水反应:Na+2H2O=Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在溶液中大量共存的是( )
A.H+ Na+ CO32﹣ Cl﹣
B.Ba2+ Na+Cl﹣ SO42﹣
C.K+ H+ SO42﹣OH﹣
D.Ag+ Al3+ NO3﹣H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废气中的H2S通过高温热分解可制取氢气:2H2S(g)![]() 2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
(1)某温度时,测得反应体系中有气体1.3lmol,反应1 min后,测得气体为l.37mol,则tmin 内H2的生成速率为___________。
(2)某温度时,H2S的转化率达到最大值的依据是_____________(选填编号)。
a.气体的压强不发生变化 b.气体的密度不发生变化
c.![]() 不发生变化 d.单位时间里分解的H2S和生成的H2一样多
不发生变化 d.单位时间里分解的H2S和生成的H2一样多
(3)实验结果如下图。图中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下、反应经过相同时间且未达到化学平衡时H2S的转化率。该反应为_____反应(填“放热”或“吸热”)。曲线b随温度的升高,向曲线a通近的原因是_________。在容器体积不变的情况下,如果要提高H2的体积分数,可采取的一种措施是________。
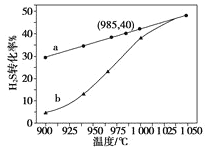
(4)使1LH2S与20L空气(空气中O2体积分数为0.2)完全反应后恢复到室温,混合气体的体积是______L 。若2gH2S完全燃烧后生成二氧化硫和水蒸气,同时放出29.4 kJ的热量,该反应的热化学方程式是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com