
【题目】下列关于醇的物理性质的描述,不适合用氢键的形成去解释的是
A. 相对分子质量相近的醇和烷烃,前者的沸点高于后者
B. 饱和一元醇,所含的碳原子数目越多,沸点越高
C. 醇的碳原子和支链数目均相同时,含羟基数越多,沸点越高
D. 甲醇、乙醇、丙醇、乙二醇、丙三醇可与水任意比互溶,彼此也互溶
 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】某有机物CxHmOn完全燃烧时需要氧气的物质的量是该有机物的x倍,则该有机物分子式中x、m、n的关系不可能是( )
A. x:m:n=1:2:1 B. m:n=2:1 C. m>2x+2 D. m≤2x+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向某恒容的密闭容器中加入1 mol N2和3 mol H2,发生反应:N2(g)+ 3H2(g)![]() 2NH3(g)。此反应达到平衡的标志是( )
2NH3(g)。此反应达到平衡的标志是( )
A. N2、H2和NH3三者共存 B. 容器内气体的浓度不再发生变化
C. N2、H2和NH3的物质的量浓度相等 D. 单位时间消耗0.1molN2的同时生成0.2 mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测显示,某地市的主要气体污染物为SO2,NOx,CO等,其主要来源为燃煤、机动车尾气。进行如下研究:
(1)为减少燃煤对SO2的排放,可将煤转化为清洁燃料水煤气(CO和H2)。
已知:H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ/mol
C(s)+1/2O2(g)=CO(g)△H=-110.5kJ/mol
写出焦炭与水蒸气反应的热化学方程式______;
(2)汽车尾气中NO是在发动机气缸中生成的,反成为:N 2(g)+O 2(g) ![]() 2NO(g) △H>0
2NO(g) △H>0
①将含0.8 mol N2和0.2molO2(近似空气组成)的混合气体充入某密闭容器中,保持1300℃反应达到平衡,测得生成8×10-4molNO 。计算该温度下此反应的化学平衡常数K=_______(填近似计算结果)。
②汽车启动后,汽缸内温度越高,单位时问内NO排放最越大,原因是______________。
(3)利用如图所示装置(电极均为惰性电极)可吸收SO2,并利用阴极排出的溶液吸收NO2。

①电极A的电极反应式为________________;电极B的电极反应式为_____________。
②碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时生成SO32-。该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A由碳、氢、氧三种元素组成。现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g。回答下列问题:
(1)3gA中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用三室式电解池(装置结构如图所示,电极均为惰性电极)可以实现用硫酸钠溶液制取硫酸和氢氧化钠。下列叙述正确的是
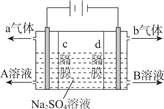
A. a气体为氢气,b气体为氧气
B. A为氢氧化钠溶液,B为硫酸溶液
C. 通电后中问隔室的SO42-向阴极迁移,阳极区溶液的pH增大
D. 该电解反应的方程式为2Na2SO4+6H2O![]() 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A→C分两步进行:①A→B,②B→C。反应过程能量变化曲线如图所示(E1、E2、E3、E4表示活化能)。下列说法正确的是
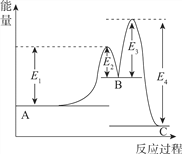
A. 两步反应的ΔH均大于0 B. 加入催化剂能改变反应的焓变
C. 三种物质中C最稳定 D. A→C反应的ΔH=E4-E1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其生产工艺如下:
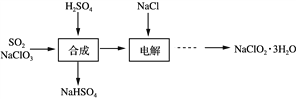
(1) “合成”步骤可以得到ClO2,其反应的化学方程式为_____________________________。
(2) “电解”步骤阳极会生成一种气体,其化学式为____________ 。
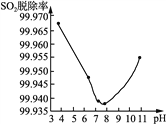
(3) 反应生成的ClO2可用于高效脱除烟气中的SO2。以ClO2脱除SO2实验时SO2脱除率与溶液pH关系如右图所示。pH在3~7.6之间时,随pH增大,ClO2氧化性减弱,脱硫率降低。而当pH>7.6时,随pH增大,SO2脱除率又升高,其原因可能为_____________________________________。
(4) 国家标准规定产品中优级纯试剂纯度≥99.8%,分析纯试剂纯度≥99.7%,化学纯试剂纯度≥99.5%。为了确定某批次NaClO2产品的等级,研究小组设计测定方案如下:取10.00 g样品,用适量蒸馏水溶解后,加入略过量的KI溶液;充分反应后,将反应液定容至200 mL,取出20.00 mL于锥形瓶;向锥形瓶中滴加两滴淀粉溶液,用2.00 mol·L-1的Na2S2O3溶液与之反应,消耗Na2S2O3溶液22.00 ml。该样品可达________试剂纯度。(写出计算过程)
已知:ClO![]() +4I-+4H+===2H2O+2I2+Cl-,I2+2S2O
+4I-+4H+===2H2O+2I2+Cl-,I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com