
【题目】下列有关晶胞的叙述,正确的是( )
A. 晶胞的结构是晶体的结构B. 不同的晶体中晶胞的大小和形状都相同
C. 晶胞中的任何一个粒子都属于该晶胞D. 已知晶胞的组成就可推知晶体的组成
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaC1O=Na2CO3+N2H4·H2O+NaCl
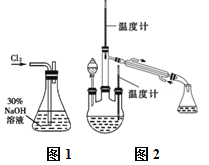
实验一:制备NaClO溶液。(实验装置如图1所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有______(填标号)。
A.玻璃棒 B.烧杯 C.烧瓶 D.容量瓶 E.胶头滴管
(2)锥形瓶中发生反应的离子方程式是___________________。
实验二:制取水合肼。(实验装置如图2所示)
(3)①仪器A的名称为_______________。
②反应过程中需控制反应温度,同时将分液漏斗中溶液缓慢滴入A中,如果滴速过快则会导致产品产率降低,同时产生大量氮气,写出该过程的化学反应方程式:__________,故分液漏斗中的溶液是______(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO
③充分反应后,加热蒸馏A内的溶液,收集108~114℃馏分,即可得到水合肼的粗产品。
实验三:测定馏分中肼含量。
(4)称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加23滴淀粉溶液,用0.10mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定时,碘的标准溶液盛放在______(填"酸式”或“碱式”)滴定管中,本实验滴定终点的现象为____________________。
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质重分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 键能愈大,表示化学键越牢固,越难以断裂
B. 成键的两原子核越近,键长越短,化学键越牢固,形成的物质的性质越稳定
C. 破坏化学键时消耗能量,而形成化学键时释放能量
D. 碘易升华,这与分子中I—I键的键能大小有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH3→CH3CH2Cl→CH2= CH2→CH3CH2OH的转化过程中,经过的反应是
A. 取代→消去→加成 B. 裂解→取代→消去
C. 取代→加成→氧化 D. 取代→消去→水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过用水溶解、过滤、蒸发等操作,可将下列各组混合物分离的是( )
A.硝酸钾、氢氧化钠
B.氧化铜、二氧化锰
C.氯化钾、二氧化锰
D.硫酸铜、氢氧化钡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测显示,某地市的主要气体污染物为SO2,NOx,CO等,其主要来源为燃煤、机动车尾气。进行如下研究:
(1)为减少燃煤对SO2的排放,可将煤转化为清洁燃料水煤气(CO和H2)。
已知:H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ/mol
C(s)+1/2O2(g)=CO(g)△H=-110.5kJ/mol
写出焦炭与水蒸气反应的热化学方程式______;
(2)汽车尾气中NO是在发动机气缸中生成的,反成为:N 2(g)+O 2(g) ![]() 2NO(g) △H>0
2NO(g) △H>0
①将含0.8 mol N2和0.2molO2(近似空气组成)的混合气体充入某密闭容器中,保持1300℃反应达到平衡,测得生成8×10-4molNO 。计算该温度下此反应的化学平衡常数K=_______(填近似计算结果)。
②汽车启动后,汽缸内温度越高,单位时问内NO排放最越大,原因是______________。
(3)利用如图所示装置(电极均为惰性电极)可吸收SO2,并利用阴极排出的溶液吸收NO2。

①电极A的电极反应式为________________;电极B的电极反应式为_____________。
②碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时生成SO32-。该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2。请设计实验证明有O2生成_____________________。
(2)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
提出问题 | 收集资料 | 提出假设 | 验证假设 | 得出结论 |
氯水中何种物质能使湿润的红色布条褪色? | ①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 | ①________。 ②盐酸使布条褪色 ③________。 ④H2O使布条褪色 | 实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色; 实验②:_________。 实验③:_______。 实验④:把红色布条放在水里,布条不褪色。 | 结论: ________ |
(3)已知室温下,H2CO3![]() HCO3-+H+Ka1(H2CO3)=4.45×10-7
HCO3-+H+Ka1(H2CO3)=4.45×10-7
HCO3-![]() CO32-+H+Ka2(H2CO3)=5.61×10-11
CO32-+H+Ka2(H2CO3)=5.61×10-11
HClO![]() H++ClO-Ka(HClO)=2.95×10-8
H++ClO-Ka(HClO)=2.95×10-8
HCN![]() H++CN-Ka(HCN)=5×10-10
H++CN-Ka(HCN)=5×10-10
少量CO2通入NaCN溶液中的化学方程式____________________
少量的氯气通入到过量的碳酸钠溶液中的离子方程式____________________;
室温下等浓度的a.NaCN溶液 b.NaClO溶液 c.NaHCO3溶液的pH从大到小的顺序是_________________;
室温下0.05mol/L NaCN溶液的pH为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质组成、分类正确的是( )
A.盐酸、硫酸、硝酸都是强氧化性酸
B.新制氯水、氨水的溶质分别是次氯酸、氨分子
C.纯碱、烧碱的成分分别是碳酸钠、氢氧化钠
D.苯、聚苯乙烯、聚乙烯的组成元素以及元素质量比相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com