
【题目】通过用水溶解、过滤、蒸发等操作,可将下列各组混合物分离的是( )
A.硝酸钾、氢氧化钠
B.氧化铜、二氧化锰
C.氯化钾、二氧化锰
D.硫酸铜、氢氧化钡
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】(1)材料是人类赖以生存和发展的重要物质基础。
①水泥是最常用的建筑材料,它属于__________(填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
②下列硅酸盐产品的生产原料中不需要石灰石的是__________(填字母)。
a.陶瓷 b.水泥 c.玻璃
③高岭土是烧制瓷器的重要原料,其组成可以表示为Al2Si2Ox(OH)y,其中x,y的数值分别是__________(填字母)。
a.5、4 b.6、3 c.7、2
④下列物品的构成材料中主要是合成高分子材料的是__________(填字母)。
a.宣纸 b.羊毛衫 c.保鲜膜
⑤橡胶是制造轮胎的主要原料,天然橡胶是__________结构(填“线型”或“体型”),需经过硫化处理改变其结构,增强其机械强度。
(2)良好的生态环境可以提升生活质量。
①汽车尾气(含有烃类、CO、NOx、SO2等)是城市空气的主要污染源,治理方法之一是在汽车排气管上加装“催化转化器”使CO、NOx转化为无害物质,下列说法不正确的是__________。
a.CO和NOx反应的化学方程式为:2xCO+2NOx![]() 2xCO2+N2
2xCO2+N2
b.上述方法增加了空气中CO2的含量,加重了酸雨污染
c.在日光照射下,汽车尾气还会产生光化学烟雾
②家庭装修中使用的装潢材料缓慢释放出来的污染物达一定浓度时会影响人体健康,下列属于常见装修污染物的是_________(填字母)。
a.NO、NO2 b.甲醛、苯 c.SO2、CO
③通过水质检测确定水体中污染物的种类和浓度后,可采取不同的方法对污水进行处理。例如向废水中通入臭氧,运用_______(填字母)除去其中含有的油类、氰化物。
a.中和法 b.沉淀法 c.氧化法
④天然水中含有细小悬浮颗粒物可以用明矾进行处理,明矾溶于水后电离出的铝离子与水反应生成氢氧化铝胶体能吸附悬浮颗粒物,写出铝离子与水反应的离子方程式____________。
(3)均衡营养、合理用药是保证人体健康的重要途径。
①葡萄糖可作为营养剂供给人体能量,其在人体内发生的主要反应是______(填字母)。
a.加成反应 b.水解反应 c.氧化反应
②维生素C能防治坏血病,可通过食用富含它的食物进行补充,碱性条件下维生素C易被空气氧化,为减少维生素C的损失,烹调食物时可加入少许 ______(填字母)。
a.白糖 b.食醋 c.苏打
③人体内有8种氨基酸必须通过食物摄入,某品牌蛋糕中含有下列物质,其中水解生成氨基酸的是____ (填字母)。
a.纤维素 b.蛋白质 c.油脂
④“胃舒平”又名复方氢氧化铝,除主要成分氢氧化铝外,还含有一定量的三硅酸镁(2MgO·3SiO2·nH2O),三硅酸镁与胃酸发生反应生成MgCl2和H2SiO3,其反应方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提碘的方法之一,其流程如下:

资料显示:Ⅰ. pH=2时,NaNO2溶液只能将 I-氧化为I2,同时生成NO
Ⅱ. I2+5Cl2+6H2O === 2HIO3+10HCl
Ⅲ. 5SO32-+2IO3-+2H+===I2+5SO42-+H2O
(1)反应①的离子方程式____________________。
(2)方案甲中,根据I2的特性,分离操作X的方法是____________。
(3)已知:反应②中每吸收3mol I2转移5mol电子,离子方程式是__________。
(4)Cl2、酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的I-却选择了价格较高的NaNO2,原因是_______________________。
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的I2、I-、IO3-。请分别检验滤液中的I-、IO3-,将实验方案补充完整。实验中可供选择的试剂:稀H2SO4、淀粉溶液、Fe2(SO4)3溶液、Na2SO3溶液
a.滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在。
b._____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,在CuZnO2催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1 平衡常数K1 反应Ⅰ
CH3OH(g)+H2O(g) △H1 平衡常数K1 反应Ⅰ
CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2 =+41.2kJmol-1 平衡常数K2 反应Ⅱ
CO(g)+H2O(g) △H2 =+41.2kJmol-1 平衡常数K2 反应Ⅱ
(1)一定条件下,将n(CO2): n(H2)=1:1的混合气体充入绝热恒容密闭容器中发生反应。下列事实可以说明反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)已达到平衡的是_______
CH3OH(g)+H2O(g)已达到平衡的是_______
A 容器内气体密度保持不变 B CO2体积分数保持不变
C 该反应的平衡常数保持不变 D 混合气体的平均相对分子质量不变
(2)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应的电极反应式是___________________。
(3)反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
(4)在恒压密闭容器中,由CO2和H2进行反应I合成甲醇,在其它条件不变的情况下,探究温度对化学平衡的影响,实验结果如图。

①△H1_________0(填“>”、“<”或“=”)
②有利于提高CO2平衡转化率的措施有___________(填标号)。
A.降低反应温度
B.投料比不变,增加反应物的物质的量
C.增大CO2和H2的初始投料比
D.混合气体中掺入一定量惰性气体(不参与反应)
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I。
①充分反应达到平衡后,若CO2转化率为a,则容器的压强与起始压强之比为________(用a表示)。
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为____________(保留三位有效数字);平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数。写出上述反应压力平衡常数KP为____________(用P0表示,并化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶胞的叙述,正确的是( )
A. 晶胞的结构是晶体的结构B. 不同的晶体中晶胞的大小和形状都相同
C. 晶胞中的任何一个粒子都属于该晶胞D. 已知晶胞的组成就可推知晶体的组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10 mL某气态烃与50 mL氧气在密闭容器中点燃恰好完全反应,测得同条件下生成的CO220 mL、CO 20 mL、水蒸气40 mL,则该烃的分子式为
A. C2H4 B. C3H8 C. C4H8 D. C4H10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素的性质正确的是( )
A. 第一电离能:B>Al>GaB. 电负性:F>N>O
C. 最高正价:F>S>SiD. 原子半径:P>N>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂生产化工原料的同时会产生多右种废液,其有机废液的主要成分为苯胺、苯酚、苯甲醇(都微溶于水),其无机废液的主要污染成分为Cr2O72-,该工厂处理废液的方法如下:
I.利用物质的酸碱性,从有机废液中分离、回收有机物
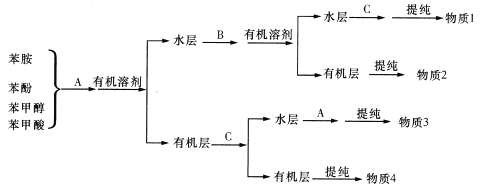
(1)物质A为______,物质B为______, 物质C为_________。(填写化学式)
(2)若想选用一种试剂仅仅将苯甲酸与其他种物质分开,则应选用的试剂是______。
II.利用纳米级Cu2O处理含有Cr2O72-的酸性废水
已知:Cu2O![]() Cu+CuSO4;pH=5时Cr3+会形成Cr(OH)3沉淀
Cu+CuSO4;pH=5时Cr3+会形成Cr(OH)3沉淀
(3)工业上用肼(N2H4)与新制的Cu(OH)2反应制备纳米级Cu2O,同时放出N2,该反应的化学方程式为____________。
(4)光照时,会在形成的微电极上发生电极反应,反应原理如下图所示,

对Cu2O的作用提出两种假设:
a. Cu2O作光催化剂;
b. Cu2O与Cr2O72-发生氧化还原反应
己知:Cu2O的添加量是1.74×10-4mol/L,Cr2O72-的初始浓度是9.60×10-4mol/L;对比实验,反应1.5小时结果如右图所示。结合试剂用量数据和实验结果可得到的结论是假设_____成立,写出该过程的正极反应方程式:_______________。
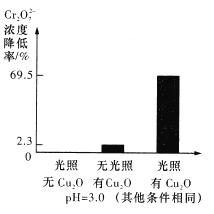
(5)溶液的pH对Cr2O72-降解率的影响如下图所示。

由上图可知,pH=3时,Cr2O72-的降解率最大;pH=2与pH=5时,Cr2O72-的降解率低的原因分别可能是___________、______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com