
【题目】(1)材料是人类赖以生存和发展的重要物质基础。
①水泥是最常用的建筑材料,它属于__________(填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
②下列硅酸盐产品的生产原料中不需要石灰石的是__________(填字母)。
a.陶瓷 b.水泥 c.玻璃
③高岭土是烧制瓷器的重要原料,其组成可以表示为Al2Si2Ox(OH)y,其中x,y的数值分别是__________(填字母)。
a.5、4 b.6、3 c.7、2
④下列物品的构成材料中主要是合成高分子材料的是__________(填字母)。
a.宣纸 b.羊毛衫 c.保鲜膜
⑤橡胶是制造轮胎的主要原料,天然橡胶是__________结构(填“线型”或“体型”),需经过硫化处理改变其结构,增强其机械强度。
(2)良好的生态环境可以提升生活质量。
①汽车尾气(含有烃类、CO、NOx、SO2等)是城市空气的主要污染源,治理方法之一是在汽车排气管上加装“催化转化器”使CO、NOx转化为无害物质,下列说法不正确的是__________。
a.CO和NOx反应的化学方程式为:2xCO+2NOx![]() 2xCO2+N2
2xCO2+N2
b.上述方法增加了空气中CO2的含量,加重了酸雨污染
c.在日光照射下,汽车尾气还会产生光化学烟雾
②家庭装修中使用的装潢材料缓慢释放出来的污染物达一定浓度时会影响人体健康,下列属于常见装修污染物的是_________(填字母)。
a.NO、NO2 b.甲醛、苯 c.SO2、CO
③通过水质检测确定水体中污染物的种类和浓度后,可采取不同的方法对污水进行处理。例如向废水中通入臭氧,运用_______(填字母)除去其中含有的油类、氰化物。
a.中和法 b.沉淀法 c.氧化法
④天然水中含有细小悬浮颗粒物可以用明矾进行处理,明矾溶于水后电离出的铝离子与水反应生成氢氧化铝胶体能吸附悬浮颗粒物,写出铝离子与水反应的离子方程式____________。
(3)均衡营养、合理用药是保证人体健康的重要途径。
①葡萄糖可作为营养剂供给人体能量,其在人体内发生的主要反应是______(填字母)。
a.加成反应 b.水解反应 c.氧化反应
②维生素C能防治坏血病,可通过食用富含它的食物进行补充,碱性条件下维生素C易被空气氧化,为减少维生素C的损失,烹调食物时可加入少许 ______(填字母)。
a.白糖 b.食醋 c.苏打
③人体内有8种氨基酸必须通过食物摄入,某品牌蛋糕中含有下列物质,其中水解生成氨基酸的是____ (填字母)。
a.纤维素 b.蛋白质 c.油脂
④“胃舒平”又名复方氢氧化铝,除主要成分氢氧化铝外,还含有一定量的三硅酸镁(2MgO·3SiO2·nH2O),三硅酸镁与胃酸发生反应生成MgCl2和H2SiO3,其反应方程式是_________。
【答案】 b a a c 线型 b b c Al3+ + 3H2O = Al(OH)3(胶体)+3H+ c b b 【答题空24-13】2MgO·3SiO2·nH2O +4HCl = 2MgCl2 + 3H2SiO3 + (n-1)H2O
【解析】试题分析:水泥的成分是硅酸盐;②
陶瓷的原料是黏土;水泥的原料是石灰石、黏土;玻璃的原料是石英砂、纯碱、石灰石;③根据化合价代数和等于0计算; ④塑料、合成橡胶和合成纤维成为合成材料;(2) ①CO2不能引起酸雨;NOx引起光化学烟雾;②装修材料黏合剂中含有甲醛、苯;③臭氧是强氧化剂;④明矾水解为氢氧化铝胶体;(3)①葡萄糖在人体内被氧化为二氧化碳和水而放热;③蛋白质水解的最终产物是氨基酸;④根据元素守恒写方程式。
解析:(1) ①水泥是硅酸盐,它属于无机非金属材料。②陶瓷的原料是黏土,故a正确;水泥的原料是石灰石、黏土,故b错误;玻璃的原料是石英砂、纯碱、石灰石,故c错误。③高岭土组成可以表示为Al2Si2Ox(OH)y,根据化合价代数和等于0。x,y的数值分别是5、4时化合价代数和不等于0,a错误; x,y的数值分别是6、3 时化合价代数和不等于0,b错误; x,y的数值分别是7、2时化合价代数和等于0,c正确。 ④下列物品的构成材料中主要是合成高分子材料的是__________(填字母)。
宣纸的材料是纤维素,是天然高分子材料,故a错误;羊毛衫的成分是蛋白质,是天然高分子材料,b错误;保鲜膜的成分是聚乙烯,是合成高分子材料,故c正确;
⑤天然橡胶是线型高分子,需经过硫化处理改变其结构,增强其机械强度。
(2)①“催化转化器”使CO、NOx转化为无害CO2和N2,CO和NOx反应的化学方程式为:2xCO+2NOx![]() 2xCO2+N2,故a正确;CO2不能引起酸雨,故b错误;
2xCO2+N2,故a正确;CO2不能引起酸雨,故b错误;
c.汽车尾气含有NOx,所以会产生光化学烟雾,故c正确;
②装修材料黏合剂中含有甲醛、苯,所以常见装修污染物的是甲醛、苯,故b正确;
③臭氧具有强氧化性,运用氧化性除去其中含有的油类、氰化物,故c正确;。
④铝离子结合水电离的氢氧根离子生成氢氧化铝胶体,离子方程式Al3+ + 3H2O ![]() Al(OH)3(胶体)+3H+。
Al(OH)3(胶体)+3H+。
(3)①葡萄糖在人体内被氧化为二氧化碳和水,发生的主要反应是氧化反应,故c正确;
②维生素C在碱性条件下易被空气氧化,所以烹调食物时可加入少许食醋,故b正确;
③蛋白质水解的最终产物是氨基酸,故b正确;
④三硅酸镁与胃酸发生反应生成MgCl2和H2SiO3,其反应方程式是2MgO·3SiO2·nH2O +4HCl = 2MgCl2 + 3H2SiO3 + (n-1)H2O。


科目:高中化学 来源: 题型:
【题目】把体积相同的甲烷和氯气充入一个集气瓶中,光照一段时间后,发现气体的黄绿色变浅,集气瓶壁上有淡黄绿色液滴,此时集气瓶内的物质最多可能有( )
A. 4种B. 5种C. 6种D. 7种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组有机物,不论以何种比值混合,只要二者物质的量之和不变,完全燃烧时所消耗的氧气的物质的量和生成的水的物质的量分别相等的是
A.甲烷和乙醇 B.乙烷和乙醇
C.苯和苯甲酸 D.乙炔和苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要使蛋白质从溶液中析出,而又不改变它的性质,应加入( )
A. 饱和(NH4)2SO4溶液 B. 稀NaOH溶液 C. 饱和CuSO4溶液 D. 乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、O均属于自然界中常见非金属元素,研究这些元素的单质和化合物具有重要意义。回答下列问题:
(1)将装有NO2和N2O4混合气体的烧瓶浸入热水中,观察到的现象是____________________,产生该现象的原因是____________________________________________。
(2)一定条件下,向2L恒容密闭容器中按体积比1:3充入4.48L(标准状况)N2和H2的混合气体,发生反应![]() 3 min时反应达到平衡状态,测得
3 min时反应达到平衡状态,测得![]() mol·L-1。
mol·L-1。
①0~3 min内![]() =________________。
=________________。
②下列叙述可证明上述反应达到平衡状态的是____________(填写代号)。
A.容器内压强保持不变
B.N2、H2和NH3的物质的量浓度不再变化
C. ![]()
D.每消耗1 mol N2,同时生成2 mol NH3
(3)戊烷常用作有机溶剂。C5H12的同分异构体有____________种,其中一氯代物只有一种的是____________________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaC1O=Na2CO3+N2H4·H2O+NaCl
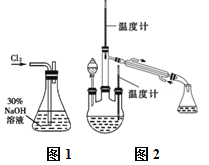
实验一:制备NaClO溶液。(实验装置如图1所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有______(填标号)。
A.玻璃棒 B.烧杯 C.烧瓶 D.容量瓶 E.胶头滴管
(2)锥形瓶中发生反应的离子方程式是___________________。
实验二:制取水合肼。(实验装置如图2所示)
(3)①仪器A的名称为_______________。
②反应过程中需控制反应温度,同时将分液漏斗中溶液缓慢滴入A中,如果滴速过快则会导致产品产率降低,同时产生大量氮气,写出该过程的化学反应方程式:__________,故分液漏斗中的溶液是______(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO
③充分反应后,加热蒸馏A内的溶液,收集108~114℃馏分,即可得到水合肼的粗产品。
实验三:测定馏分中肼含量。
(4)称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加23滴淀粉溶液,用0.10mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定时,碘的标准溶液盛放在______(填"酸式”或“碱式”)滴定管中,本实验滴定终点的现象为____________________。
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质重分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事件表明有机化学成为一门独立化学分支的是( )
A.1828年德国化学家维勒首次在实验室里合成了尿素
B.19世纪初,瑞典化学家贝采利乌斯首次使用“有机”一词,并提出了“有机化学”和“有机化合物”的概念
C.1965年我国科学家人工合成了具有生物活性的蛋白质﹣﹣结晶牛胰岛素
D.1830年,德国化学家李比希创立了有机化合物的定量分析方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
某化学小组根据上述反应原理进行下列实验:
Ⅰ.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol·L-1KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在________(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会________(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为________。
(4)计算H2C2O4溶液的物质的量浓度为________mol·L-1。
Ⅱ.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1mol·L-1KMnO4溶液 | 0.1mol·L-1H2C2 O4溶液 | 0.1mol·L-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中V1=________,V2=________。
(6)实验中需要测量的数据是________。
(7)实验中________(填“能”或“不能”)用0.2mol·L-1盐酸代替0.1mol·L-1H2SO4溶液,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过用水溶解、过滤、蒸发等操作,可将下列各组混合物分离的是( )
A.硝酸钾、氢氧化钠
B.氧化铜、二氧化锰
C.氯化钾、二氧化锰
D.硫酸铜、氢氧化钡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com