
【题目】下列离子方程式书写正确的是 ( )
A. 碳酸氢钠与盐酸反应:CO32-+2H+=CO2↑+H2O
B. 次氯酸钙溶液中通入过量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C. 二氧化锰与浓盐酸共热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D. 钠与水反应:Na+2H2O=Na++2OH-+H2↑
科目:高中化学 来源: 题型:
【题目】已知某元素+3价离子的电子排布式为1s22s22p63s23p63d3,该元素在周期表中的位置和区域是( )
A. 第三周期第ⅥB族;p区B. 第三周期第ⅢB族;ds区
C. 第四周期第ⅥB族;d区D. 第四周期第ⅢB族;f区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH3→CH3CH2Cl→CH2= CH2→CH3CH2OH的转化过程中,经过的反应是
A. 取代→消去→加成 B. 裂解→取代→消去
C. 取代→加成→氧化 D. 取代→消去→水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测显示,某地市的主要气体污染物为SO2,NOx,CO等,其主要来源为燃煤、机动车尾气。进行如下研究:
(1)为减少燃煤对SO2的排放,可将煤转化为清洁燃料水煤气(CO和H2)。
已知:H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ/mol
C(s)+1/2O2(g)=CO(g)△H=-110.5kJ/mol
写出焦炭与水蒸气反应的热化学方程式______;
(2)汽车尾气中NO是在发动机气缸中生成的,反成为:N 2(g)+O 2(g) ![]() 2NO(g) △H>0
2NO(g) △H>0
①将含0.8 mol N2和0.2molO2(近似空气组成)的混合气体充入某密闭容器中,保持1300℃反应达到平衡,测得生成8×10-4molNO 。计算该温度下此反应的化学平衡常数K=_______(填近似计算结果)。
②汽车启动后,汽缸内温度越高,单位时问内NO排放最越大,原因是______________。
(3)利用如图所示装置(电极均为惰性电极)可吸收SO2,并利用阴极排出的溶液吸收NO2。

①电极A的电极反应式为________________;电极B的电极反应式为_____________。
②碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时生成SO32-。该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2。请设计实验证明有O2生成_____________________。
(2)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
提出问题 | 收集资料 | 提出假设 | 验证假设 | 得出结论 |
氯水中何种物质能使湿润的红色布条褪色? | ①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 | ①________。 ②盐酸使布条褪色 ③________。 ④H2O使布条褪色 | 实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色; 实验②:_________。 实验③:_______。 实验④:把红色布条放在水里,布条不褪色。 | 结论: ________ |
(3)已知室温下,H2CO3![]() HCO3-+H+Ka1(H2CO3)=4.45×10-7
HCO3-+H+Ka1(H2CO3)=4.45×10-7
HCO3-![]() CO32-+H+Ka2(H2CO3)=5.61×10-11
CO32-+H+Ka2(H2CO3)=5.61×10-11
HClO![]() H++ClO-Ka(HClO)=2.95×10-8
H++ClO-Ka(HClO)=2.95×10-8
HCN![]() H++CN-Ka(HCN)=5×10-10
H++CN-Ka(HCN)=5×10-10
少量CO2通入NaCN溶液中的化学方程式____________________
少量的氯气通入到过量的碳酸钠溶液中的离子方程式____________________;
室温下等浓度的a.NaCN溶液 b.NaClO溶液 c.NaHCO3溶液的pH从大到小的顺序是_________________;
室温下0.05mol/L NaCN溶液的pH为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用三室式电解池(装置结构如图所示,电极均为惰性电极)可以实现用硫酸钠溶液制取硫酸和氢氧化钠。下列叙述正确的是
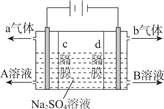
A. a气体为氢气,b气体为氧气
B. A为氢氧化钠溶液,B为硫酸溶液
C. 通电后中问隔室的SO42-向阴极迁移,阳极区溶液的pH增大
D. 该电解反应的方程式为2Na2SO4+6H2O![]() 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.6 g Fe全部溶于200 mL一定浓度的硝酸溶液中,得到标准状况下的气体2.24 L(该气体可能为NO或NO2或NO和NO2的混合气体),又测得反应后溶液中H+的物质的量浓度为0.2 mol·L-1(设反应前后溶液体积的变化忽略不计)。下列说法正确的是( )
A. 2.24 L气体是NO和NO2的混合气体
B. 反应后的溶液中含有Fe2+和Fe3+
C. 反应后的溶液中c(NO![]() )=1.5 mol·L-1
)=1.5 mol·L-1
D. 反应后的溶液最多还能再溶解3.64 g Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A.某无色透明的酸性溶液:Cl﹣、Na+、MnO4﹣、SO42﹣
B.能使pH试纸变深蓝色的溶液:Na+、NH4+、K+、CO32﹣
C.加入过量NaOH溶液后可得到澄清的溶液:K+、Ba2+、HCO3﹣、Cl﹣
D.常温下pH=12的溶液:K+、Ba2+、Cl﹣、NO3﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com