
【题目】下列各组离子一定能大量共存的是( )
A.某无色透明的酸性溶液:Cl﹣、Na+、MnO4﹣、SO42﹣
B.能使pH试纸变深蓝色的溶液:Na+、NH4+、K+、CO32﹣
C.加入过量NaOH溶液后可得到澄清的溶液:K+、Ba2+、HCO3﹣、Cl﹣
D.常温下pH=12的溶液:K+、Ba2+、Cl﹣、NO3﹣
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. 碳酸氢钠与盐酸反应:CO32-+2H+=CO2↑+H2O
B. 次氯酸钙溶液中通入过量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C. 二氧化锰与浓盐酸共热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D. 钠与水反应:Na+2H2O=Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为主要原料合成一种具有果香味的物质C和化合物D的合成路线如下图所示。

请回答下列问题:
(1)A的结构简式为_______________,B分子中的官能团名称为____________。
(2)反应⑦中物质X的分子式为____________,反应⑧的类型为____________。
(3)反应⑤的化学方程式为______________________________。反应⑥用于实验室制乙烯,为除去其中可能混有的SO2应选用的试剂是____________。
(4)已知D的相对分子量为118,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则D的分子式为____________。
(5)请补充完整证明反应①是否发生的实验方案:取反应①的溶液2 mL于试管中,_________________________________________________________________________。
实验中可供选择的试剂:10%的NaOH溶液、5%的CuSO4溶液、碘水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废气中的H2S通过高温热分解可制取氢气:2H2S(g)![]() 2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
(1)某温度时,测得反应体系中有气体1.3lmol,反应1 min后,测得气体为l.37mol,则tmin 内H2的生成速率为___________。
(2)某温度时,H2S的转化率达到最大值的依据是_____________(选填编号)。
a.气体的压强不发生变化 b.气体的密度不发生变化
c.![]() 不发生变化 d.单位时间里分解的H2S和生成的H2一样多
不发生变化 d.单位时间里分解的H2S和生成的H2一样多
(3)实验结果如下图。图中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下、反应经过相同时间且未达到化学平衡时H2S的转化率。该反应为_____反应(填“放热”或“吸热”)。曲线b随温度的升高,向曲线a通近的原因是_________。在容器体积不变的情况下,如果要提高H2的体积分数,可采取的一种措施是________。
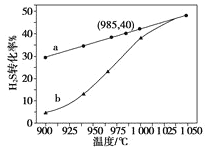
(4)使1LH2S与20L空气(空气中O2体积分数为0.2)完全反应后恢复到室温,混合气体的体积是______L 。若2gH2S完全燃烧后生成二氧化硫和水蒸气,同时放出29.4 kJ的热量,该反应的热化学方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下进行反应:COCl2(g) ![]() Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),反应过程中测得的有关数据见下表:
Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法不正确的是( )
A. 使用恰当的催化剂能加快该反应速率
B. 该条件下,COCl2的最大转化率为60%
C. 6s时,反应达到最大限度即化学平衡状态
D. 生成Cl2的平均反应速率,0~2s比2~4s快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。A是黑色非金属单质,C、E、F均为氧化物,E、F常温下呈气态,且E能使品红褪色,G是一种常见的无色液体,I是一种难溶于水的白色胶状沉淀,能溶于B溶液。请回答下列问题:

(1) C的化学式为________。
(2)G的电子式为________。
(3)写出①反应的化学方程式:_______________________________________________。
(4)写出过量的F参加反应时②的离子方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的有机化工原料。
(1)已知:
①C2H4(g)+H2O(g) ![]() C2H5OH(g) ΔH1=-45.5kJ/mol
C2H5OH(g) ΔH1=-45.5kJ/mol
②2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH2=-23.9kJ/mol
CH3OCH3(g)+H2O(g) ΔH2=-23.9kJ/mol
③C2H4OH(g) ![]() CH3OCH3(g) ΔH3=+50.7kJ/mol
CH3OCH3(g) ΔH3=+50.7kJ/mol
请写出乙烯和水蒸气化合生成甲醇气体的热化学方程式:_____________。
(2)合成甲醇的反应为:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1:2的CO和H2的混合气体,改变温度进行实验,测得反应进行到t min时甲醇的体积分数如图甲所示。
CH3OH(g) ΔH。相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1:2的CO和H2的混合气体,改变温度进行实验,测得反应进行到t min时甲醇的体积分数如图甲所示。

①温度升高甲醇的体积分数增大的原因是___________;
②根据图像判断ΔH________________(填“>”、“<”或“=”)0。
(3)某研究小组提出将4CH3OH+6NO2+8OH-=3N2+4CO32-+12H2O设计成原电池,以实现污染物的利用,装置如图乙所示(图中电极均为多孔的惰性电极)。

①电极A的名称是_____________。
②写出原电池电极B的电极反应式:___________。
③若用该电池对铁制品表面镀铜,反应一段时间后,铁制品质量增加64g,理论上处理NO2的质量为________g。
(4)为了研究甲醇转化为二甲醚的反应条件,某研究与小组在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2=-23.9KJ/mol。
CH3OCH3(g)+H2O(g) ΔH2=-23.9KJ/mol。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
Ⅰ | T1 | 0.20 | 0.080 | 0.080 |
Ⅱ | T1 | 0.40 | a | a |
Ⅲ | T2 | 0.20 | 0.090 | 0.090 |
①T1温度下该反应的平衡常数K=_______;反应温度T1_________T2(填“大于”或“小于”。)
②容器Ⅱ中a=______。
③下列说法能说明反应达到平衡状态的是___________(填字母)。
A.容器中气体压强不再变化
B.用CH3OH 和CH3OCH3表示的反应速率之比为2:1
C.混合气体的密度不变
D.容器内CH3OH和CH3OCH3的浓度之比为2:1
E.单位时间内生成2molCH3OH 的同时生成1mol H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的钠进行下列实验,其中生成氢气最多的是 ( )
A.将钠投入到足量水中 B.将钠用铝箱包好并刺一些小孔,再放入足量的水中
C.将钠放入足量硫酸铜溶液中 D.将钠放入足量稀盐酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性无色溶液中,下列各组离子一定能大量共存的是( )
A.MnO4﹣、H+、K+、NO3﹣
B.Na+、H+、Cl﹣、NO3﹣
C.Ba2+、H+、SO42﹣、Cl﹣
D.H+、Fe3+、SO42﹣、Cl﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com