
【题目】甲醇是一种重要的有机化工原料。
(1)已知:
①C2H4(g)+H2O(g) ![]() C2H5OH(g) ΔH1=-45.5kJ/mol
C2H5OH(g) ΔH1=-45.5kJ/mol
②2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH2=-23.9kJ/mol
CH3OCH3(g)+H2O(g) ΔH2=-23.9kJ/mol
③C2H4OH(g) ![]() CH3OCH3(g) ΔH3=+50.7kJ/mol
CH3OCH3(g) ΔH3=+50.7kJ/mol
请写出乙烯和水蒸气化合生成甲醇气体的热化学方程式:_____________。
(2)合成甲醇的反应为:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1:2的CO和H2的混合气体,改变温度进行实验,测得反应进行到t min时甲醇的体积分数如图甲所示。
CH3OH(g) ΔH。相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1:2的CO和H2的混合气体,改变温度进行实验,测得反应进行到t min时甲醇的体积分数如图甲所示。

①温度升高甲醇的体积分数增大的原因是___________;
②根据图像判断ΔH________________(填“>”、“<”或“=”)0。
(3)某研究小组提出将4CH3OH+6NO2+8OH-=3N2+4CO32-+12H2O设计成原电池,以实现污染物的利用,装置如图乙所示(图中电极均为多孔的惰性电极)。

①电极A的名称是_____________。
②写出原电池电极B的电极反应式:___________。
③若用该电池对铁制品表面镀铜,反应一段时间后,铁制品质量增加64g,理论上处理NO2的质量为________g。
(4)为了研究甲醇转化为二甲醚的反应条件,某研究与小组在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2=-23.9KJ/mol。
CH3OCH3(g)+H2O(g) ΔH2=-23.9KJ/mol。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
Ⅰ | T1 | 0.20 | 0.080 | 0.080 |
Ⅱ | T1 | 0.40 | a | a |
Ⅲ | T2 | 0.20 | 0.090 | 0.090 |
①T1温度下该反应的平衡常数K=_______;反应温度T1_________T2(填“大于”或“小于”。)
②容器Ⅱ中a=______。
③下列说法能说明反应达到平衡状态的是___________(填字母)。
A.容器中气体压强不再变化
B.用CH3OH 和CH3OCH3表示的反应速率之比为2:1
C.混合气体的密度不变
D.容器内CH3OH和CH3OCH3的浓度之比为2:1
E.单位时间内生成2molCH3OH 的同时生成1mol H2O(g)
【答案】 C2H4(g)+2H2O(g)![]() 2CH3OH(g) ΔH2=+29.1kJ/mol a到c反应未达平衡,温度越高反应速率越快,甲醇的体积分数越大 < 负极 2NO2+4H2O+8e-=N2+8OH- 23 4 大于 0.160 E
2CH3OH(g) ΔH2=+29.1kJ/mol a到c反应未达平衡,温度越高反应速率越快,甲醇的体积分数越大 < 负极 2NO2+4H2O+8e-=N2+8OH- 23 4 大于 0.160 E
【解析】(1)已知:①C2H4(g)+H2O(g)→C2H5OH(g) ΔH1=-45.5kJ/mol,② 2CH3OH(g)→CH3OCH3(g)+H2O(g) ΔH2=-23.9kJ/mol,③C2H5OH(g)→CH3OCH3(g) ΔH3=+50.7kJ/mol,根据盖斯定律可知①+③-②即得到乙烯和水蒸气化合生成甲醇气体的热化学方程式为 C2H4(g)+2H2O(g)→2CH3OH(g) ΔH2=+29.1kJ/mol。(2)①根据图像可知a到c反应未达平衡,温度越高反应速率越快,因此甲醇的体积分数越大;②根据图像可判断甲醇含量达到最高后反应达到平衡状态,继续加热甲醇含量降低,说明升高温度平衡向逆反应方向进行,因此ΔH<0。(3)①电极A通入的是甲醇,甲醇失去电子,所以电极的名称是负极。②原电池电极B是正极,NO2达到电子转化为氮气,电解质溶液显碱性,则电极反应式为2NO2+4H2O+8e-=N2+8OH-。③若用该电池对铁制品表面镀铜,反应一段时间后,铁制品质量增加64g,即有1mol析出。电路中转移2mol电子,则根据电子得失守恒可知理论上消耗2mol÷4=0.5mol,NO2的质量为23g。(4)
① 2CH3OH(g)→CH3OCH3(g)+H2O(g)
起始浓度(mol/L) 0.20 0 0
转化浓度(mol/L) 0.160 0.080 0.080
平衡浓度(mol/L) 0.040 0.080 0.080
所以T1温度下该反应的平衡常数K=![]() ;
;
起始量相同,平衡时二甲醚是0.090mol,这说明平衡向正反应方向进行。由于正反应是放热反应,所以反应温度T1大于T2;②容器Ⅰ、Ⅱ中温度相同,由于反应前后体积不变,平衡等效,所以a=0.160。③A.由于反应前后体积不变,因此容器中气体压强不再变化不能说明反应达到平衡状态,A错误;B.根据方程式可知用CH3OH 和CH3OCH3表示的反应速率之比始终为2:1,不能说明达到平衡状态,B错误;C.密度是气体的质量和容器容积的比值,反应过程质量和容积均不变,所以混合气体的密度不变不能说明达到平衡状态,C错误;D.容器内CH3OH和CH3OCH3的浓度之比为2:1不能说明正逆反应速率相等,不一定达到平衡状态,D错误;E.单位时间内生成2molCH3OH 的同时生成1mol H2O(g)表示正逆反应速率相等,达到平衡状态,E正确,答案选E。


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质组成、分类正确的是( )
A.盐酸、硫酸、硝酸都是强氧化性酸
B.新制氯水、氨水的溶质分别是次氯酸、氨分子
C.纯碱、烧碱的成分分别是碳酸钠、氢氧化钠
D.苯、聚苯乙烯、聚乙烯的组成元素以及元素质量比相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A.某无色透明的酸性溶液:Cl﹣、Na+、MnO4﹣、SO42﹣
B.能使pH试纸变深蓝色的溶液:Na+、NH4+、K+、CO32﹣
C.加入过量NaOH溶液后可得到澄清的溶液:K+、Ba2+、HCO3﹣、Cl﹣
D.常温下pH=12的溶液:K+、Ba2+、Cl﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,几种难溶氢氧化物的饱和溶液中金属离子浓度的负对数与溶液的pH关系如下图所示。下列说法正确的是
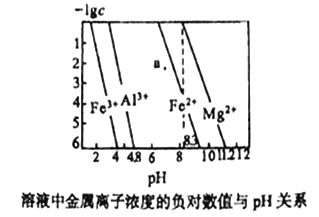
A. a点代表Fe(OH)2饱和溶液
B. Ksp[Fe(OH)3]< Ksp[Al(OH)3]< Ksp[Fe(OH)2]< Ksp[Mg(OH)2]
C. 向0.1mol/L Al3+、Mg2+、Fe2+混合溶液中,逐滴滴加稀NaOH溶液,Mg2+最先沉淀
D. 在pH=7的溶液中,Fe3+、Al3+、Fe2+能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的两份铝分别放入过量盐酸和氢氧化钠溶液中,放出的氢气在相同状况下的体积比 ( )
A. 1:1 B. 1:6 C. 2:3 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上有一种方法是用CO2生产燃料甲醇(CH3OH)。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
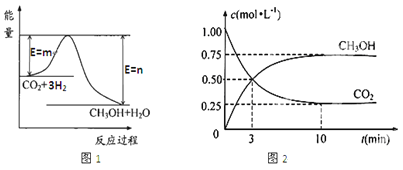
(1)该反应为_________热反应,原因是_____________________。
(2)下列能说明该反应已经达到平衡状态的是_________(填序号)
A.v (H2)=3v(CO2) B.容器内气体压强保持不变
C.v逆(CO2)=v正(CH3OH) D.容器内气体密度保持不变
E.CH3OH 中1 mol H—O键断裂的同时2 mol C=O键断裂
F. 混合气体的平均摩尔质量不变
(3)在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)=________。 达平衡时容器内平衡时与起始时的压强比____________。
(4)甲醇、氧气在酸性条件下可构成燃料电池,其负极的电极反应为________________,
与铅蓄电池相比,当消耗相同质量的负极物质时,甲醇燃料电池的理论放电量是铅蓄电池的___________倍(保留小数点后1位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂质的方法不正确的是( )
A.铜粉中混有铁粉:加入过量盐酸充分反应,过滤
B.CO2中混有HCl:将其通入NaOH溶液,洗气
C.NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体
D.FeCl2溶液中混有少量FeC13:加入Fe粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com