
【题目】将5.6 g Fe全部溶于200 mL一定浓度的硝酸溶液中,得到标准状况下的气体2.24 L(该气体可能为NO或NO2或NO和NO2的混合气体),又测得反应后溶液中H+的物质的量浓度为0.2 mol·L-1(设反应前后溶液体积的变化忽略不计)。下列说法正确的是( )
A. 2.24 L气体是NO和NO2的混合气体
B. 反应后的溶液中含有Fe2+和Fe3+
C. 反应后的溶液中c(NO![]() )=1.5 mol·L-1
)=1.5 mol·L-1
D. 反应后的溶液最多还能再溶解3.64 g Fe
【答案】D
【解析】n(Fe)=![]() =0.1mol,n(气体)=
=0.1mol,n(气体)=![]() =0.1mol,测得反应后溶液中H+的浓度为0.2molL-1,则硝酸过量;A.由电子守恒可知,0.1mol×(3-0)=0.1mol×(5-x),解得x=2,即气体为NO,故A错误;B.硝酸过量,反应后溶液中含有Fe3+,故B错误;C.由N原子守恒可知,c(NO3-)=
=0.1mol,测得反应后溶液中H+的浓度为0.2molL-1,则硝酸过量;A.由电子守恒可知,0.1mol×(3-0)=0.1mol×(5-x),解得x=2,即气体为NO,故A错误;B.硝酸过量,反应后溶液中含有Fe3+,故B错误;C.由N原子守恒可知,c(NO3-)=![]() =1.7mol/L,故C错误;D.原硝酸的物质的量为0.1mol×3+0.2L×0.2mol/L+0.1mol=0.44mol,由3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O可知,最多消耗Fe为0.44mol×
=1.7mol/L,故C错误;D.原硝酸的物质的量为0.1mol×3+0.2L×0.2mol/L+0.1mol=0.44mol,由3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O可知,最多消耗Fe为0.44mol×![]() ×56g/mol=9.24g,则最多还能在溶解9.24-5.6=3.64g,故D正确;故选D。
×56g/mol=9.24g,则最多还能在溶解9.24-5.6=3.64g,故D正确;故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子能在呈酸性的无色溶液中大量共存的是( )
A.Ba2+、Na+、NO3﹣、MnO4﹣
B.Mg2+、Cl﹣、Al3+、SO42﹣
C.K+、OH﹣、HCO3﹣、NO3﹣
D.Ca2+、Na+、Fe3+、SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. 碳酸氢钠与盐酸反应:CO32-+2H+=CO2↑+H2O
B. 次氯酸钙溶液中通入过量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C. 二氧化锰与浓盐酸共热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D. 钠与水反应:Na+2H2O=Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在溶液中大量共存的是( )
A.H+ Na+ CO32﹣ Cl﹣
B.Ba2+ Na+Cl﹣ SO42﹣
C.K+ H+ SO42﹣OH﹣
D.Ag+ Al3+ NO3﹣H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近两年流行喝苹果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品。苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构式如下,下列说法不正确的是

A.苹果酸在一定条件下能发生酯化反应
B.苹果酸在一定条件下能发生催化氧化反应
C.苹果酸在一定条件下能发生消去反应
D.1 mol苹果酸与Na2CO3溶液反应最多消耗3 mol Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为主要原料合成一种具有果香味的物质C和化合物D的合成路线如下图所示。

请回答下列问题:
(1)A的结构简式为_______________,B分子中的官能团名称为____________。
(2)反应⑦中物质X的分子式为____________,反应⑧的类型为____________。
(3)反应⑤的化学方程式为______________________________。反应⑥用于实验室制乙烯,为除去其中可能混有的SO2应选用的试剂是____________。
(4)已知D的相对分子量为118,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则D的分子式为____________。
(5)请补充完整证明反应①是否发生的实验方案:取反应①的溶液2 mL于试管中,_________________________________________________________________________。
实验中可供选择的试剂:10%的NaOH溶液、5%的CuSO4溶液、碘水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废气中的H2S通过高温热分解可制取氢气:2H2S(g)![]() 2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
(1)某温度时,测得反应体系中有气体1.3lmol,反应1 min后,测得气体为l.37mol,则tmin 内H2的生成速率为___________。
(2)某温度时,H2S的转化率达到最大值的依据是_____________(选填编号)。
a.气体的压强不发生变化 b.气体的密度不发生变化
c.![]() 不发生变化 d.单位时间里分解的H2S和生成的H2一样多
不发生变化 d.单位时间里分解的H2S和生成的H2一样多
(3)实验结果如下图。图中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下、反应经过相同时间且未达到化学平衡时H2S的转化率。该反应为_____反应(填“放热”或“吸热”)。曲线b随温度的升高,向曲线a通近的原因是_________。在容器体积不变的情况下,如果要提高H2的体积分数,可采取的一种措施是________。
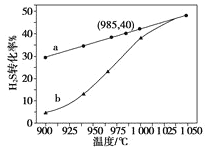
(4)使1LH2S与20L空气(空气中O2体积分数为0.2)完全反应后恢复到室温,混合气体的体积是______L 。若2gH2S完全燃烧后生成二氧化硫和水蒸气,同时放出29.4 kJ的热量,该反应的热化学方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的钠进行下列实验,其中生成氢气最多的是 ( )
A.将钠投入到足量水中 B.将钠用铝箱包好并刺一些小孔,再放入足量的水中
C.将钠放入足量硫酸铜溶液中 D.将钠放入足量稀盐酸中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com