
【题目】下列说法正确的是
A.分子中一定存在化学键
B.分子中若有化学键,则一定存在σ键
C.p和p轨道不能形成σ键
D.含π键的物质不如含σ键的物质稳定
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 键能愈大,表示化学键越牢固,越难以断裂
B. 成键的两原子核越近,键长越短,化学键越牢固,形成的物质的性质越稳定
C. 破坏化学键时消耗能量,而形成化学键时释放能量
D. 碘易升华,这与分子中I—I键的键能大小有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2。请设计实验证明有O2生成_____________________。
(2)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
提出问题 | 收集资料 | 提出假设 | 验证假设 | 得出结论 |
氯水中何种物质能使湿润的红色布条褪色? | ①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 | ①________。 ②盐酸使布条褪色 ③________。 ④H2O使布条褪色 | 实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色; 实验②:_________。 实验③:_______。 实验④:把红色布条放在水里,布条不褪色。 | 结论: ________ |
(3)已知室温下,H2CO3![]() HCO3-+H+Ka1(H2CO3)=4.45×10-7
HCO3-+H+Ka1(H2CO3)=4.45×10-7
HCO3-![]() CO32-+H+Ka2(H2CO3)=5.61×10-11
CO32-+H+Ka2(H2CO3)=5.61×10-11
HClO![]() H++ClO-Ka(HClO)=2.95×10-8
H++ClO-Ka(HClO)=2.95×10-8
HCN![]() H++CN-Ka(HCN)=5×10-10
H++CN-Ka(HCN)=5×10-10
少量CO2通入NaCN溶液中的化学方程式____________________
少量的氯气通入到过量的碳酸钠溶液中的离子方程式____________________;
室温下等浓度的a.NaCN溶液 b.NaClO溶液 c.NaHCO3溶液的pH从大到小的顺序是_________________;
室温下0.05mol/L NaCN溶液的pH为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多晶硅是单质硅的一种形态,是制造硅抛光片、太阳能电池及高纯硅制晶的主要原料。已知多晶硅第三代工业制取流程如图所示:
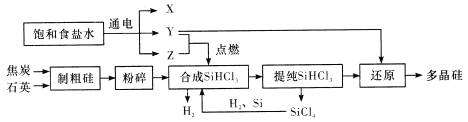
下列说法错误的是
A. Y、Z分别为H2、Cl2
B. 制取粗硅的过程中焦炭与石英会发生副反应生成碳化硅,在该副反应中,氧化剂与还原剂的物质的量之比为1:1
C. SiHCl3极易水解,其完全水解的产物为H2SiO3、H2、HCl,据此推测SiHCl3中硅元素的化合价为+2价
D. Y与SiHCl3制备多晶硅的反应属于置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.6 g Fe全部溶于200 mL一定浓度的硝酸溶液中,得到标准状况下的气体2.24 L(该气体可能为NO或NO2或NO和NO2的混合气体),又测得反应后溶液中H+的物质的量浓度为0.2 mol·L-1(设反应前后溶液体积的变化忽略不计)。下列说法正确的是( )
A. 2.24 L气体是NO和NO2的混合气体
B. 反应后的溶液中含有Fe2+和Fe3+
C. 反应后的溶液中c(NO![]() )=1.5 mol·L-1
)=1.5 mol·L-1
D. 反应后的溶液最多还能再溶解3.64 g Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在2 L密闭容器内,反应2NO2(g)![]() N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
(1)用NO2表示0~2 s内该反应的平均速度___________.在第5 s时,NO2的转化率为_____。根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是_____________________。
(2)上述反应在第3 s后达到平衡,能说明该反应已达到平衡状态的是______。
a.单位时间内,消耗2 mol NO2的同时生成1 mol的N2O4
b.容器内压强保持不变
c.v逆(NO2)=2v正(N2O4)
d.容器内密度保持不变
(3)在2 s内,该反应_______(“吸收”或“放出”) _______热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质组成、分类正确的是( )
A.盐酸、硫酸、硝酸都是强氧化性酸
B.新制氯水、氨水的溶质分别是次氯酸、氨分子
C.纯碱、烧碱的成分分别是碳酸钠、氢氧化钠
D.苯、聚苯乙烯、聚乙烯的组成元素以及元素质量比相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上有一种方法是用CO2生产燃料甲醇(CH3OH)。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
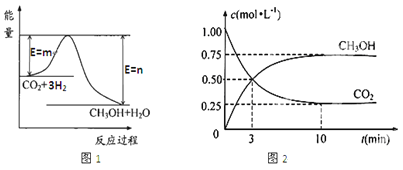
(1)该反应为_________热反应,原因是_____________________。
(2)下列能说明该反应已经达到平衡状态的是_________(填序号)
A.v (H2)=3v(CO2) B.容器内气体压强保持不变
C.v逆(CO2)=v正(CH3OH) D.容器内气体密度保持不变
E.CH3OH 中1 mol H—O键断裂的同时2 mol C=O键断裂
F. 混合气体的平均摩尔质量不变
(3)在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)=________。 达平衡时容器内平衡时与起始时的压强比____________。
(4)甲醇、氧气在酸性条件下可构成燃料电池,其负极的电极反应为________________,
与铅蓄电池相比,当消耗相同质量的负极物质时,甲醇燃料电池的理论放电量是铅蓄电池的___________倍(保留小数点后1位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com