
【题目】已知下列两个热化学方程式:
H2(g)+ ![]() O2(g)═H2O(l)△H=﹣285kJ/mol
O2(g)═H2O(l)△H=﹣285kJ/mol
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共3mol完全燃烧生成液态水时放热2790kJ,则混合气体中H2和C3H8的体积比为 .
(2)已知:H2O(l)═H2O(g)△H=+44.0kJ/mol,写出丙烷燃烧生成CO2和气态水的热化学方程式: .
【答案】
(1)2:1
(2)C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=﹣2044kJ/mol
【解析】解:(1)由热化学方程式可知,氢气的燃烧热为285kJ/mol,丙烷的燃烧热为2220.0kJ/mol.H2和C3H8的混合气体共3mol,完全燃烧生成液态水时放热2790kJ,则混合气体中H2和C3H8的平均燃烧热为 ![]() =930kJ/mol,根据十字交叉法计算H2和C3H8的体积比:
=930kJ/mol,根据十字交叉法计算H2和C3H8的体积比: 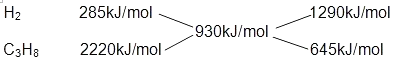 故H2和C3H8的体积比为1290kJ/mol:645kJ/mol=2:1.所以答案是:2:1.(2)已知:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(1);△H=﹣2220.0kJ/mol②H2O(1)=H2O(g);△H=+44.0kJ/mol由盖斯定律可知,①+②×4得C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=﹣2044kJ/mol,所以答案是:C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=﹣2044kJ/mol.
故H2和C3H8的体积比为1290kJ/mol:645kJ/mol=2:1.所以答案是:2:1.(2)已知:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(1);△H=﹣2220.0kJ/mol②H2O(1)=H2O(g);△H=+44.0kJ/mol由盖斯定律可知,①+②×4得C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=﹣2044kJ/mol,所以答案是:C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H=﹣2044kJ/mol.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B. 2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
C. 加热0.1 mol·L-1Na2CO3溶液,CO![]() 的水解程度和溶液的pH均增大
的水解程度和溶液的pH均增大
D. 对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.原子最外层电子数等于或大于3(小于8)的元素一定是非金属元素
B.原子最外层只有1个电子的元素一定是金属元素
C.最外层电子数比次外层电子数多的元素一定位于第二周期
D.某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。

(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是______________。
(2)Ⅱ中,2NO(g)+O2(g)![]() 2NO2(g)。在其他条件相
2NO2(g)。在其他条件相
同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图)。

①比较p1、p2的大小关系:p1________p2(填“<”,“>”或“=”)
②随温度升高,该反应平衡常数变化的趋势是________(填“增大”,“减小”或“不变”)。
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g)![]() N2O4(g) ΔH12NO2(g)
N2O4(g) ΔH12NO2(g)![]() N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母)________。

②N2O4与O2、H2O化合的化学方程式是____________________。

(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。为使电解产物全部转化为NH4NO3,需补充A。A是______,说明理由:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2SO3易被KMnO4等强氧化剂氧化,现将18mL 0.2mol/L的K2SO3溶液与含有2.4×10-3mol KMnO4溶液混合,正好完全反应。则反应后锰元素的价态为( )
A.+6B.+4C.+3D.+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、X是中学化学中常见的4种物质,其转化关系如图,其中甲和X不可能是

A. 甲为C2H5OH、X为O2 B. 甲为H2S、X为O2
C. 甲为HNO3、X为Fe D. 甲为AlCl 3溶液、X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度时,在3L密闭容器中进行的某一可逆反应,该反应中的X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示。由图中数据分析:

①该反应的化学方程式:______________________。
②反应开始至3min末,Z的反应速率为_____________________。
③该反应是由_____________开始反应的。(填“正反应”、“逆反应”或“正、逆反应同时”)
(2)将SO2、O2在某密闭容器中混合,在450 ℃发生反应:2SO2(g)+O2(g) ![]() SO3(g)。
SO3(g)。
①增大压强,则正反应速率________(填:增大、减小或不变,下同),逆反应速率________。
②维持容器容积不变,加入0.1 mol SO2的一瞬间,正反应速率________,逆反应速率________;若加入的是0.1 mol He,则正、逆反应速率________。
③若维持容器压强不变,加入0.1 mol He后,容器的容积________,物质的浓度________,反应速率________。
(3)在100℃时,将0.100mol N2O4气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
c(N2O4)/mol·L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
①该反应的平衡常数表达式为___________;从表中分析:c1___________c2, c3___________c4(填“>”、“<”或“=”)。
②在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为________mol·L-1·s-1
③若在相同条件下,起始时只充入0.080 mol NO2气体,则达到平衡时NO2气体的转化率为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com