
【题目】(1)某温度时,在3L密闭容器中进行的某一可逆反应,该反应中的X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示。由图中数据分析:

①该反应的化学方程式:______________________。
②反应开始至3min末,Z的反应速率为_____________________。
③该反应是由_____________开始反应的。(填“正反应”、“逆反应”或“正、逆反应同时”)
(2)将SO2、O2在某密闭容器中混合,在450 ℃发生反应:2SO2(g)+O2(g) ![]() SO3(g)。
SO3(g)。
①增大压强,则正反应速率________(填:增大、减小或不变,下同),逆反应速率________。
②维持容器容积不变,加入0.1 mol SO2的一瞬间,正反应速率________,逆反应速率________;若加入的是0.1 mol He,则正、逆反应速率________。
③若维持容器压强不变,加入0.1 mol He后,容器的容积________,物质的浓度________,反应速率________。
(3)在100℃时,将0.100mol N2O4气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
c(N2O4)/mol·L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
①该反应的平衡常数表达式为___________;从表中分析:c1___________c2, c3___________c4(填“>”、“<”或“=”)。
②在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为________mol·L-1·s-1
③若在相同条件下,起始时只充入0.080 mol NO2气体,则达到平衡时NO2气体的转化率为_________。
【答案】 2Z+Y![]() 3X 0.044 mol/(L·min) 正、逆反应同时 增大 增大 增大 不变 不变 增大 减小 减小 K=
3X 0.044 mol/(L·min) 正、逆反应同时 增大 增大 增大 不变 不变 增大 减小 减小 K= < = 0.001 25%
< = 0.001 25%
【解析】试题分析:(1)①由图可知,X的物质的量增加为生成物,Y、Z的物质的量减少为反应物,最后反应物的物质的量为定值不为0,是可逆反应,物质的量变化量之比等于化学计量数之比。
②根据![]() 计算反应开始至3min末Z的反应速率。
计算反应开始至3min末Z的反应速率。
③开始时,反应物、生成物的浓度都不是0;
(2)①根据影响反应速率的因素分析;
②维持容器容积不变,加入0.1 mol SO2的一瞬间,反应物浓度突然增大,生成物浓度没变;若加入的是0.1 mol He,反应物、生成物都不变。
③若维持容器压强不变,加入0.1 mol He后,容器的容积增大;
(3)①将0.100mol N2O4气体充入1L恒容抽空的密闭容器中,发生的反应是N2O4![]() 2 NO2,根据平衡常数的定义写表达式;根据元素守恒计算c1、c2, c3、c4。
2 NO2,根据平衡常数的定义写表达式;根据元素守恒计算c1、c2, c3、c4。
②根据![]() 计算N2O4的平均反应速率;
计算N2O4的平均反应速率;
③根据平衡常数,计算起始时只充入0.080 mol NO2气体,达到平衡时NO2、N2O4的浓度,再计算NO2气体的转化率。
解析:(1)①由图可知,X的物质的量增加为生成物,Y、Z的物质的量减少为反应物,最后反应物的物质的量为定值不为0,是可逆反应,Y、Z、X的物质的量变化量之比为(1.2-1.0)mol:(2.0-1.6)mol:(1.0-0.4)mol=1:2:3,物质的量变化量之比等于化学计量数之比,所以化学方程式是2Z+Y![]() 3X。
3X。
②根据![]() ,反应开始至3min末Z的反应速率
,反应开始至3min末Z的反应速率![]() mol/(L·min) 。
mol/(L·min) 。
③开始时,反应物、生成物的浓度都不是0,所以开始时正逆反应速率都不是0,该反应是由正、逆反应同时开始反应的;
(2)①增大压强,容器体积减小,反应物、生成物浓度均增大,则正反应速率增大,逆反应速率增大。
②维持容器容积不变,加入0.1 mol SO2的一瞬间,反应物浓度突然增大,生成物浓度没变,所以正反应速率增大,逆反应速率不变;若加入的是0.1 mol He,反应物、生成物都不变,则正、逆反应速率都不变。
③若维持容器压强不变,加入0.1 mol He后,容器的容积增大,物质的浓度减小,反应速率减小;
(3)①将0.100mol N2O4气体充入1L恒容抽空的密闭容器中,发生的反应是N2O4![]() 2 NO2,平衡常数表达式是
2 NO2,平衡常数表达式是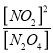 ;根据元素守恒,20s时,
;根据元素守恒,20s时, ![]() 0.06, 则
0.06, 则 ![]() 0.07,所以 c1=0.07;40s时,
0.07,所以 c1=0.07;40s时, ![]() 0.05,则
0.05,则![]() 0.1,所以c2=0.1;60s时,
0.1,所以c2=0.1;60s时, ![]() 0.12, 则
0.12, 则 ![]() 0.04,所以 c3=0.04;60s时,
0.04,所以 c3=0.04;60s时, ![]() 0.12, 则
0.12, 则 ![]() 0.04,所以 c4=0.04;故c1<c2, c3=c4 ;
0.04,所以 c4=0.04;故c1<c2, c3=c4 ;
②根据图表数据,60s时达到平衡, ![]() =
=![]() 0.001 mol·L-1·s-1;
0.001 mol·L-1·s-1;
③相同条件下,该反应的平衡常数是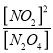 =
=![]() ,
,
起始时只充入0.080 mol NO2气体,

![]() ,x=0.01或0.16,舍去0.16,
,x=0.01或0.16,舍去0.16,
NO2气体的转化率![]() 。
。


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】已知下列两个热化学方程式:
H2(g)+ ![]() O2(g)═H2O(l)△H=﹣285kJ/mol
O2(g)═H2O(l)△H=﹣285kJ/mol
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共3mol完全燃烧生成液态水时放热2790kJ,则混合气体中H2和C3H8的体积比为 .
(2)已知:H2O(l)═H2O(g)△H=+44.0kJ/mol,写出丙烷燃烧生成CO2和气态水的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图装置测定中和热的实验步骤如下: 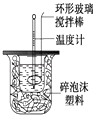
①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,并测出其温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式(中和热数值为57.3kJ/mol): .
(2)倒入NaOH溶液的正确操作是 .
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)实验数据如表:
①请填写下表中的空白:
温度 | 起始温 | 终止温度t2/℃ | 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
3 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=( 保留一位小数).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-1200KJ/mol,温度不同(T2>T1)其他条件相同时,下列图像正确的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质作用时,反应条件(温度、反应物用量)改变,不会引起产物改变的是( )
A. Fe 和HCl B. NaOH 和CO2 C. Na 和O2 D. AlCl3和NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com