
【题目】高分子化合物材料PET聚酯和PMMA的合成路线如图:

已知:
Ⅰ.RCOOR′+R″![]() OH
OH![]() RCO18OR″+R′OH(R、R′、R″代表烃基)
RCO18OR″+R′OH(R、R′、R″代表烃基)
Ⅱ.![]()
![]()
![]() (R、R′代表烃基)
(R、R′代表烃基)
(1)PMMA单体的化学名称 _________________。
(2)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为________________。反应⑤、⑥的反应类型____________ 、________________。
(3)G的分子式_____________,G中官能团的名称_____________、______________,2分子G可形成环状化合物,写出化学方程式 ____________。
(4)I的某种同分异构体与I具有相同官能团,且为顺式结构,其结构简式是 _____________。
(5)写出与F互为同分异构体且含单官能团的两种有机物的结构简式 ___________________。
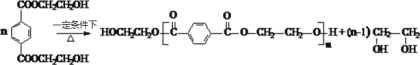
(6)写出由PET单体制备PET聚酯并生成B的化学方程式 ______________。
【答案】甲基丙烯酸甲酯 ![]() 氧化反应 消去反应 C4H8O3 羟基 羧基 2
氧化反应 消去反应 C4H8O3 羟基 羧基 2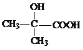
![]()
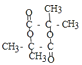 +2H2O
+2H2O 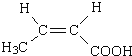 CH3CH2CHO
CH3CH2CHO ![]() (
(![]() 、
、![]() )
) 
【解析】
本题考查有机物的推断,充分利用题中信息和有机物的结构进行推断,明确有机物的官能团及其性质是解答本题的关键。根据题中各物质转化关系,由PMMA的结构可知,PMMA单体为CH2=C(CH3)COOCH3,E氧化得F,F的核磁共振氢谱显示只有一组峰,F发生已知Ⅱ中的反应得G,G在浓硫酸作用下发生消去反应得I,结合PMMA单体的结构和E的分子式可知,E为CH3CHOHCH3,F为CH3COCH3,G为(CH3)2C(OH)COOH,I为CH2=C(CH3)COOH,所以D为HOCH3。乙烯与溴发生加成反应生成A为BrCH2CH2Br,A在碱性条件下水解得B为HOCH2CH2OH,B与对苯二甲酸二甲酯发生取代反应生成PET单体为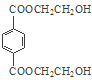 ,PET单体发生已知Ⅰ的反应得PET聚酯,据此答题。
,PET单体发生已知Ⅰ的反应得PET聚酯,据此答题。
根据题中各物质转化关系,由PMMA的结构可知,PMMA单体为CH2=C(CH3)COOCH3,E氧化得F,F的核磁共振氢谱显示只有一组峰,F发生已知Ⅱ中的反应得G,G在浓硫酸作用下发生消去反应得I,结合PMMA单体的结构和E的分子式可知,E为CH3CHOHCH3,F为CH3COCH3,G为(CH3)2C(OH)COOH,I为CH2=C(CH3)COOH,所以D为HOCH3,乙烯与溴发生加成反应生成A为BrCH2CH2Br,A在碱性条件下水解得B为HOCH2CH2OH,B与对苯二甲酸二甲酯发生取代反应生成PET单体为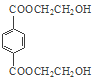 ,PET单体发生已知Ⅰ的反应得PET聚酯。
,PET单体发生已知Ⅰ的反应得PET聚酯。
(1)PMMA单体为CH2=C(CH3)COOCH3,其名称是甲基丙烯酸甲酯。本小题答案为:甲基丙烯酸甲酯。
(2)2-丙醇发生氧化反应生成丙酮,该反应方程式为![]() ,反应⑤、⑥的反应类型氧化反应、消去反应。本小题答案为:
,反应⑤、⑥的反应类型氧化反应、消去反应。本小题答案为:![]() ;氧化反应;消去反应。
;氧化反应;消去反应。
(3)G为(CH3)2C(OH)COOH,其分子式为C4H8O3,其官能团名称是羟基、羧基,2分子G可形成环状化合物,即环酯,方程式为: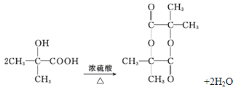 。本小题答案为:C4H8O3;羟基;羧基;
。本小题答案为:C4H8O3;羟基;羧基;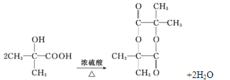 。
。
(4)I的某种同分异构体与I具有相同官能团,且为顺式结构,其结构简式是;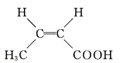 。本小题答案为:
。本小题答案为: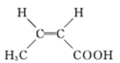 。
。
(5)与F互为同分异构体且含单官能团的所有有机物的结构简式为CH3CH2CHO、![]() 。本小题案为:CH3CH2CHO、
。本小题案为:CH3CH2CHO、![]() (
(![]() 、
、![]() )。
)。
(6)由PET单体制备PET聚酯并生成B的化学方程式为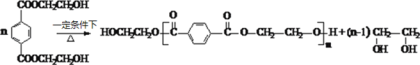 。
。


科目:高中化学 来源: 题型:
【题目】(1)6.02×1023个氢氧根离子的物质的量是________mol,其摩尔质量为________。
(2)在标准状况下,0.01 mol某气体的质量为0.44 g,则该气体的密度为________g·L1(保留小数点后两位),该气体的相对分子质量为________。
(3)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是________,CO的体积分数是________,CO的质量分数是________,C和O原子个数比是________,混合气体的平均相对分子质量是________,密度是________g·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.石油裂化、裂解和分馏均为化学变化
B.煤焦油中可以分离出苯、甲苯、二甲苯等有机化合物
C.利用CO2制造全降解塑料能有效减少环境污染
D.生物质能来源于植物及其加工产品所贮存的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
(1)水质优劣直接影响人体健康.天然水在净化处理过程中加入的混凝剂可以是 (填两种物质的名称),其净水作用的原理是
(2)水的净化与软化的区别是
(3)硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO).若某天然水中c(Ca2+)=1.2×10﹣3mol/L,c(Mg2+)=6×10﹣4mol/L,则此水的硬度为 .
(4)若(3)中的天然水还含有c(HCO3﹣)=8×10﹣4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2 克,后加入Na2CO3 克.
(5)如图是电渗析法淡化海水的原理图,其中,电极A接直流电源的正极,电极B接直流电源的负极.

①隔膜A是 (填“阴”或“阳”)离子交换膜;
②某种海水样品,经分析含有大量的Na+、Cl﹣,以及少量的K+、SO42﹣.若用上述装置对该海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL0.3mol/LNa2SO4溶液和100mL0.2mol/LAl2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度约为:( )
A. 0.2mol/LB. 0.25mol/LC. 0.45mol/LD. 0.50mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用生产钛白的副产品FeSO4与软锰矿(主要成分是MnO2)可制备高纯MnO2。
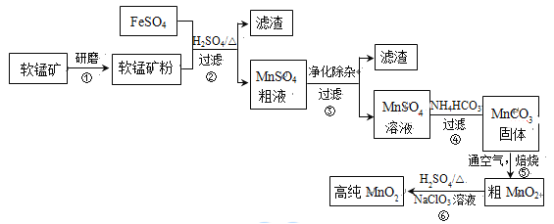
(1)步骤①中研磨的目的是_________。
(2)步骤②中主要发生的反应是FeSO4与MnO2转化为MnSO4与_________。
(3)步骤②中Mn2+浸出率受初始H2SO4浓度与温度的影响如下图所示。

软锰矿粉酸浸的适宜条件是__________。
(4)步骤②中,若硫酸初始浓度小于1.8mol/L,反应进行一段时间后,有红褐色固体析出,其原因是____________。
(5)已知MnSO4粗液中还含有Al3+、Fe3+和Ni2+离子,溶液中离子生成氢氧化物的pH如下表:
Al(OH)3 | Fe(OH)3 | Ni(OH)2 | Mn(OH)2 | |
开始沉淀时pH | 3.4 | 1.5 | 6.9 | 8.2 |
完全沉淀时pH | 4.7 | 2.8 | 8.9 | 10.2 |
注:金属离子的起始浓度为0.1mol/L
步骤③进行的操作是:调节pH=5.4,过滤,滤渣中含_____。
(6)已知:几种难溶物的溶解平衡常数K
化学式 | MnCO3 | NiCO3 | MnS | NiS |
K | 2.24×10-11 | 1.42×10-7 | 4.65×10-14 | 1.07×10-21 |
步骤③还需加入的除杂试剂是_______固体(填序号)。
a.Na2CO3 b.MnCO3 c.Na2S d.MnS
(7)步骤⑤中焙烧MnCO3制MnO2,发生反应的化学方程式是______。固体产物除MnO2外,还可能存在______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+I2(g)![]() 2HI(g) ΔH<0,在一带有活塞的密闭容器中达到平衡,下列说法不正确的是 ( )
2HI(g) ΔH<0,在一带有活塞的密闭容器中达到平衡,下列说法不正确的是 ( )
A. 恒温,压缩体积,平衡不移动,颜色加深
B. 恒压,迅速充入HI,开始时正反应速率减小
C. 恒容,升温逆反应速率增大,正反应速率减小
D. 恒容,充入H2,I2转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述不正确的是( )

A. 该滴定过程应选择甲基橙作为指示剂
B. M点对应的盐酸体积小于20.0 mL
C. M点: c(NH4+)+ c(NH3·H2O) =c(Cl-)
D. M点处的溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:
①卤块的主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质
②四种化合物的溶解度(S)随温度(T)变化的曲线如图所示。

回答下列问题:
(1)过滤所需要的主要玻璃仪器有______________________。
(2)加入BaCl2溶液的目的是______________________,加MgO后过滤所得滤渣的主要成分为___________(写化学式)
(3)加入NaClO3饱和溶液后发生反应的化学方程式为_______________________。再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①蒸发结晶,②_______________,③将滤液冷却结晶,④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定[已知Mg(ClO3)2·6H2O的摩尔质量为299g·mol-1]。
步骤1:准确称量3.50g产品配成100mL溶液。
步骤2:取出10.00mL溶液于锥形瓶中,加入10.00mL稀硫酸和21.00mL.1.000mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol·L-1K2Cr2O7溶液滴定剩余的Fe2+至终点[发生的反应为Cr2O72-+Fe2++H+→Cr3++Fe3++H2O(未配平)]
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL
步骤2中发生反应的离子方程式为_____________________________。该样品中Mg(ClO3)2·6H2O的纯度为___________(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com