
【题目】碳酸钠和碳酸氢钠是生活中常见的物质.请回答下列问题.
(1)碳酸氢钠俗称 , 其水溶液显性.(填“酸”、“碱”或“中”).
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为 .
等物质的量的碳酸钠和碳酸氢钠分别与足量盐酸反应时生成CO2的量,前者后者(填“>”、“<”或“=”).
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为 .
【答案】
(1)小苏打;碱
(2)HCO3﹣+H+=H2O+CO2↑;=
(3)2NaHCO3 ![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
【解析】解:(1)碳酸氢钠俗称小苏打,水溶液中碳酸氢根离子水解结合水电离出的氢离子,促进水电离平衡正向进行,HCO3﹣+H2OH2CO3+OH﹣ , 氢氧根离子浓度增大,溶液显碱性,故答案为:小苏打;碱;(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,碳酸氢钠和胃酸中的盐酸反应生成二氧化碳、水和氯化钠,反应的离子方程式为HCO3﹣+H+=H2O+CO2↑,等物质的量的碳酸钠和碳酸氢钠分别与足量盐酸反应,Na2CO3+2HCl=2NaCl+CO2↑+H2O,NaHCO3+HCl=NaCl+CO2↑+H2O,生成CO2的量相同,
故答案为:HCO3﹣+H+=H2O+CO2↑;=;(3)除去碳酸钠固体中碳酸氢钠的反应是碳酸氢钠固体受热分解,碳酸钠不分解,反应的化学方程式为:2NaHCO3 ![]() Na2CO3+CO2↑+H2O,
Na2CO3+CO2↑+H2O,
故答案为:2NaHCO3 ![]() Na2CO3+CO2↑+H2O.
Na2CO3+CO2↑+H2O.
(1)碳酸氢钠俗称小苏打,水溶液中碳酸氢根离子水解结合水电离出的氢离子,促进水电离平衡正向进行,氢氧根离子浓度增大,溶液显碱性;(2)碳酸氢钠和胃酸中的盐酸反应生成二氧化碳、水和氯化钠,等物质的量的碳酸钠和碳酸氢钠分别与足量盐酸反应时生成CO2的量依据碳元素守恒分析;(3)碳酸氢钠固体受热分解,碳酸钠不分解.


科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下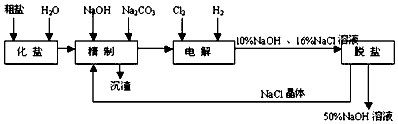
(1)粗盐中含CaCl2、MgCl2等杂质,写出精制过程中发生反应的化学方程式是 , .
(2)如果粗盐中SO42﹣含量较高,必须添加钡式剂除去SO42﹣ , 该钡试剂可以是
A.Ba(OH)2
B.Ba(NO3)2
C.BaCl2
(3)电解过程中所发生反应的化学方程式为 , 与电源正极相连的电极附近产生的气体是 , 检验该气体可使用试纸,现象是试纸变为色.
(4)氯碱工厂生产的氯气和氢气可以进一步用于生产盐酸,主要过程如下: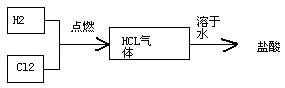
其中关键的一步为氯气和氢气在燃烧管口燃烧生成HCl,氯气有毒,应采取的措施是 . 合成盐酸厂要求合成气中的HCl的含量要大于97%,试用最简便的方法进行分析是否含量大于97% .
(5)氯碱工厂生产的氯气和氢氧化钠溶液可以用于制取“84消毒液”,反应的化学方程式为 .
(6)某同学欲证明盐酸与氯化氢气体性质不同,他分别向A、B、C三支洁净试管中各放入一片干燥的蓝色石蕊试纸,然后往A试管内加入盐酸,试纸显色,往B试管中通入干燥的氯化氢气体,试纸显色.最后向C试管中加入物质(填化学式),他之所以加入这种物质的理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地壳里含量占第一、第二位元素之间形成的化合物不具有的性质是( )
A. 熔点高,硬度大B. 常温下能与烧碱溶液反应
C. 高温下能与生石灰反应D. 能与水蒸气反应生成酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O.一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成 4.48L 氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变).请计算:
MnCl2+Cl2↑+2H2O.一定质量的二氧化锰溶解在100mL过量的浓盐酸中,当反应生成 4.48L 氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变).请计算:
(1)反应耗用MnO2的质量
(2)被氧化的HCl物质的量
(3)原浓盐酸的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下化学用语及对应表达正确的是( )
A.H218O 的摩尔质量为20gmol﹣1
B.铁粉溶于盐酸的化学方程式:2Fe+6HCl=2FeCl3+3H2↑
C.氯离子的结构示意图: ![]()
D.乙醇的分子式为CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置可应用于实验室制氯气并回收二氯化锰的实验,能达到实验目的是( )
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离出MnCl2溶液中的固体MnO2
D.用装置丁称得回收的二氯化锰质量为5.36g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W是由A、B两种元素组成的AB2型化合物.
(1)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛.则W为(填化学式).请写出该反应的化学方程式:
(2)若取两支试管分别加入少量W溶液,往一支试管中滴入KSCN溶液,无明显现象.
往另一支试管中加入足量氯水,再加入适量CCl4 , 振荡,静置,下层溶液呈紫红色;往上层溶液中滴入KSCN溶液,溶液呈红色.
①W溶液中所含金属阳离子为 .
②上述实验中,W与足量氯水反应的离子方程式为: .
(3)若W是大气主要污染物之一,也是空气质量预报必报的气体.可用酸性高锰酸钾溶液检验该污染物.
①请写出该反应的离子方程式:
②1mol W与酸性高锰酸钾溶液充分反应,转移电子的物质的量为mol.
(4)若W是产生光化学烟雾主要气体之一,其溶于水能生成一种一元强酸.
①请写出W溶于水的化学方程式:
②该气体W可用氢氧化钠溶液来处理,请写出该反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知测定中和热的实验步骤如下:
①量取50mL 0.25mol/L硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
请回答:
(1)NaOH溶液稍过量的原因 .
(2)加入NaOH溶液的正确操作是__________(填字母).
A.沿玻璃棒缓慢加入
B.一次迅速加入
C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是 .
(4)设溶液的密度均为1gcm﹣3 , 中和后溶液的比热容c=4.18J(g℃)﹣1 , 请根据实验数据求出中和热为 ,写出该反应的热化学方程式 .
温度 | 起始温度t1/℃ | 终止温度 | 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 |
(5)若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量(填“小于”、“等于”或“大于”)57.3kJ,原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化在给定条件下能实现的是( ) ①FeS2 ![]() SO3
SO3 ![]() H2SO4
H2SO4
②Al2O3 ![]() NaAlO2(aq)
NaAlO2(aq) ![]() Al(OH)3
Al(OH)3
③NaCl(aq) ![]() Na
Na ![]() Na2O2
Na2O2
④Fe ![]() FeSO4(aq)
FeSO4(aq) ![]() Fe(OH)2
Fe(OH)2 ![]() Fe2O3
Fe2O3
⑤海水 ![]() 母液
母液 ![]() 粗溴
粗溴 ![]()
![]()
![]() Br2 .
Br2 .
A.①③⑤
B.②③④
C.②④⑤
D.①④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com