
【题目】对下列实验装置图中所示的实验操作评价合理的是
A. 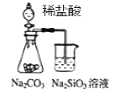 可能证明非金属性强弱:Cl>C>Si
可能证明非金属性强弱:Cl>C>Si
B. 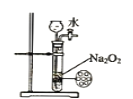 装置可用来制备少量氧气,并且控制反应的发生与停止
装置可用来制备少量氧气,并且控制反应的发生与停止
C. 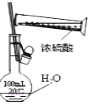 配制一定物质的量浓度的硫酸溶液不能直接在容量瓶中进行
配制一定物质的量浓度的硫酸溶液不能直接在容量瓶中进行
D. 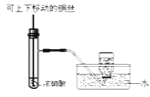 制备并收集少量NO2气体
制备并收集少量NO2气体
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

(1)B装置的作用是_________________________________________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有____________气体产生,写出D中发生反应的离子方程式______________________。若去掉C,能否得出同样结论____________(填“是”或“否”) ,原因是____________________________。
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请帮他完成表中内容。(试剂,仪器和用品自选)
实验步骤 | 预期现象 | 结论 |
___________________________ | ________________________ | 固体残留物仅为Fe2O3 |
(4)若E中收集到的气体只有N2,其物质的量为xmol,固体残留物Fe2O3的物质的量为ymol,D中沉淀物质的量为zmol,则x、y和z应满足的关系为________________________。
(5)结合上述实验现象,完成硫酸亚铁铵在500℃时隔绝空气加热完全分解的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“生活无处不化学”,请你回答下列问题。
(1)食盐不慎洒落在天然气的火焰上,观察到现象是______,该变化称为______反应。
(2)沾有水的铁制器皿在高温火焰上会发黑,该反应的化学方程式是_______。
(3)小苏打(碳酸氢钠)可用于中和过多的胃酸,写出该反应的离子方程式______。
(4)使用“84”消毒液(含 NaClO)时,按一定比例与水混合,并在空气中浸泡一段时间,使 NaClO 与H2O及空气中的CO2充分 反应,目的是得到杀菌消毒效果更好的______(填物质名称),该反应的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是 ________(用字母代号填)。
A.Fe B.FeCl3C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是 ________nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_________________________________________________________。
某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是_________________________,在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为43.05 g.溶液中c(Cl-)= mol/L.
(4)若要验证该溶液中含有Fe2+,正确的实验方法是 。
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+。
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+。
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:

A请写出上述实验中加入或生成的有关物质的化学式:
①_____________②____________③______________④________________
B请写出通入⑥的化学方程式__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧锂离子电池的正极材料,主要成分为 LiCoO2(难溶于水)还含有 Al以及少量 Ca、Mg、Cu、Fe 等。制备 Co3O4 微球的工艺流程如下:
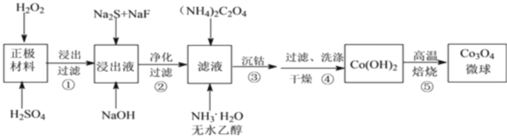
回答下列问题:
(1)LiCoO2 中 Co 元素的化合价为______。
(2)配平步骤①中生成 Co2+的离子方程式为_____LiCoO2 +____H++_____H2 O2 =_____Co2++_____O2 ![]() +_____Li++_____H 2O此过程中若用浓盐酸代替 H2SO4 和 H2O2的混合溶液,除因挥发使其利用率降低外,还有的缺点是_____。
+_____Li++_____H 2O此过程中若用浓盐酸代替 H2SO4 和 H2O2的混合溶液,除因挥发使其利用率降低外,还有的缺点是_____。
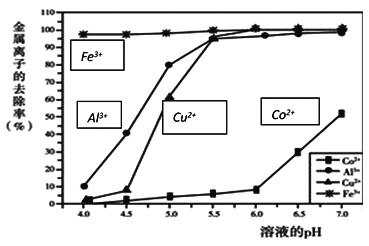
(3)步骤②中,不同 pH 下溶液中金属离子的去除效果如下图所示。该过程加入NaOH调节溶液 pH 的最佳范围是______,理由是______。
(4)步骤④中,过滤、洗涤操作均需用到的玻璃仪器有烧杯、玻璃棒、_____。
(5)步骤⑤中,Co(OH)2 在空气中高温焙烧生成 Co3O4 的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得。

下列说法中正确的是
A. 一分子雷琐苯乙酮含有3个碳碳双键
B. 苹果酸的一种缩聚产物是![]()
C. 1mol伞形酮与足量NaOH溶液反应,最多可消耗2mol NaOH
D. 雷琐苯乙酮、苹果酸、伞形酮都能跟FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取少量黑色固体,洗涤后,_______(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3 min时量少;溶液红色较3 min时加深 |
ⅲ | 120 | 产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据_______现象,判断溶液中存在Ag+,可产生Fe3+。
③ 下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是部分矿物资源的利用及产品流程(如图),有关说法不平确的是
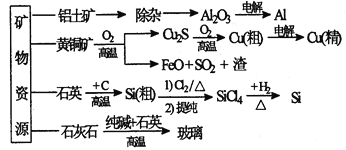
A. 粗铜电解精炼时,粗铜作阳极
B. 生产铝、铜、高纯硅及玻璃过程中都涉及氧化还原反应
C. 黄铜矿冶铜时,副产物SO2可用于生产硫酸,FeO可用作冶铁的原料
D. 粗硅制高纯硅时,提纯四氯化硅可用多次分馏的方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com