
分析 混合物与盐酸恰好完全反应,所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为FeCl2,发生反应:Fe+2H+=Fe2++H2↑、Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,设原混合物中Fe和Fe2O3的物质的量分别为xmol、ymol,表示出与HCl反应的Fe的物质的量,结合氢气的体积与二者质量之和列方程计算,再根据m=nM计算Fe和Fe2O3的质量,根据氯离子守恒参与反应的n(HCl)=2n(FeCl2),根据Fe元素守恒可知n(FeCl2)=n(Fe)+2n(Fe2O3),再根据c=$\frac{n}{V}$计算HCl的物质的量浓度.
解答 解:(1)生成氢气物质的量为:$\frac{2.016L}{22.4L/mol}$=0.09mol,
设原混合物中Fe和Fe2O3的物质的量分别为x、y,则:
Fe2O3+6H+=2Fe3++3H2O
ymol 2ymol
Fe+2 Fe3+=3Fe2+
ymol 2ymol
Fe+2H+=Fe2++H2↑
(x-y)mol (x-y)mol
根据题意,得方程:x-y=0.09mol
56x+160y=7.2g
联立方程,解得x=0.1mol,y=0.01mol
故m(Fe)=0.1 mol×56 g•mol-1=5.6g
m(Fe2O3)=0.01 mol×160 g•mol-1=1.6 g
答:原混合物中Fe2O3和Fe的质量分别为1.6g和5.6 g;
(2)参与反应的n(HCl)=2n(FeCl2)=2[n(Fe)+2n(Fe2O3)]=2×[0.1mol+2×0.01mol]=0.24 mol
c(HCl)=$\frac{0.24mol}{0.12L}$=2.0 mol/L
答:原盐酸的物质的量浓度为:1.0 mol/L.
点评 本题考查混合物计算、根据反应方程式进行的计算,难度中等,明确溶液中发生的化学反应是解答本题的关键,注意(2)中利用原子守恒等来解答.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
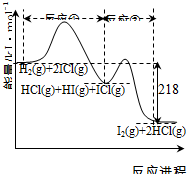
| A. | 反应①、反应②均为放热反应 | |
| B. | 反应①、反应②均为氧化还原反应 | |
| C. | 反应①比反应②的速率慢,与相应正反应的活化能无关 | |
| D. | 反应①、反应②的焓变之和为△H=-218kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
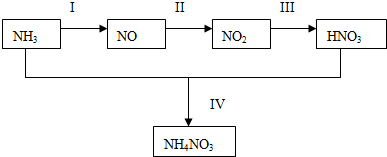
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
B | 17.9 | 290 | 1.26 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜,当电路中通过的电子数为0.1NA时,阳极质量减少为3.2g | |
| B. | 0.5L1 mol•L-1NaHS溶液中,Na+和HS-离子数之和为NA | |
| C. | Na2O2和Na2S的固体混合物7.8g,其中Na+数为0.3NA | |
| D. | 3.0g甲醛和甲酸甲酯的混合物中含有的原子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用聚光手电筒照射NaCl溶液和Fe(OH)3胶体时,产生的现象不相同 | |
| B. | 胶粒能透过滤纸,但不能透过半透膜 | |
| C. | 胶体与其他分散系的本质区别是丁达尔效应 | |
| D. | Al(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除去暖瓶中的水垢:2H++CaCO3═Ca2++CO2↑+H2O | |
| B. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 硫酸氢钠溶液与氢氧化钡溶液混合呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | FeO与稀硝酸反应:FeO+2H+═Fe2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中:Fe3+、Al3+、I-、S2- | |
| B. | 水电离的H+浓度为 10-12mol•L-1的溶液中:Cl-、CO32-、NH4+、SO32- | |
| C. | 使石蕊变红的溶液中:Fe2+、MnO4-、Na+、SO42- | |
| D. | pH=11的溶液中:Na+、Cl-、S2-、SO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com