
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)反应:N2(g)+O2(g)![]() 2NO(g) △H1=+180.5kJ·mol-1
2NO(g) △H1=+180.5kJ·mol-1
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H2。
N2(g)+2CO2(g) △H2。
已知CO的燃烧热为283.0 kJ·mol-1,则△H=_______________。
(2)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)![]() 2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)
2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
Ⅰ.2NO(g) ![]() N2O2(g)(快);v1正=k1正·c2(NO); v1逆=k1逆·c(N2O2) △H1<0
N2O2(g)(快);v1正=k1正·c2(NO); v1逆=k1逆·c(N2O2) △H1<0
Ⅱ.N2O2(g)+O2(g)=2NO2(g)(慢);v2正=k2正·c(N2O2)c(O2);v2逆=k2逆·c2(NO2) △H2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=_________。
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=_________。
②决定2NO(g)+O2(g)![]() 2NO2(g)速率的是反应_________(填“Ⅰ”或“Ⅱ”),反应Ⅰ的活化能E1与反应Ⅱ的活化能E2的大小关系为E1______E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是__________。
2NO2(g)速率的是反应_________(填“Ⅰ”或“Ⅱ”),反应Ⅰ的活化能E1与反应Ⅱ的活化能E2的大小关系为E1______E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是__________。
A.k2正增大,c(N2O2)增大 B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小 D.k2正减小,c(N2O2)增大
(3)在一定温度下向容积为2L的密闭容器中加入0.5molNO、0.5molCO,此时容器总压为P0kPa,发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),4min时达平衡,此时测得氮气的物质的量为0.2mol,则0-4min内用CO2表示的平均速率为_______mol·L-1·min-1,用平衡分压表示的平衡常数KP=__________(用含有P0的代数式表示)。达平衡后,若改变下列条件,既能加快反应速率又能提高NO的转化率的是____________
N2(g)+2CO2(g),4min时达平衡,此时测得氮气的物质的量为0.2mol,则0-4min内用CO2表示的平均速率为_______mol·L-1·min-1,用平衡分压表示的平衡常数KP=__________(用含有P0的代数式表示)。达平衡后,若改变下列条件,既能加快反应速率又能提高NO的转化率的是____________
A.增大压强 B.降低温度 C.再加入0.5molNO、0.5molCO D.分离出部分N2
【答案】-746.5kJ·mol-1 ![]() Ⅱ < C 0.05
Ⅱ < C 0.05 ![]() AC
AC
【解析】
根据盖斯定律进行计算;根据化学平衡状态和平衡常数的表达式进行解答;运用三段式,根据阿伏伽德罗定律,利用分压计算化学反应速率,根据影响化学反应速率和平衡移动的因素进行判断。
(1)根据反应:①N2(g)+O2(g)![]() 2NO(g) △H1=+180.5kJ·mol-1,②2CO(g) +O2(g)
2NO(g) △H1=+180.5kJ·mol-1,②2CO(g) +O2(g)![]() 2CO2(g)△H2=-283.0 kJ·mol-1
2CO2(g)△H2=-283.0 kJ·mol-1![]() 2=-566.0 kJ·mol-1,②-①得2NO(g)+2CO(g)
2=-566.0 kJ·mol-1,②-①得2NO(g)+2CO(g)![]() N2(g)+2CO2(g),由盖斯定律,△H=-566.0 kJ·mol-1-180.5kJ·mol-1=-746.5kJ·mol-1,故答案:-746.5kJ·mol-1;
N2(g)+2CO2(g),由盖斯定律,△H=-566.0 kJ·mol-1-180.5kJ·mol-1=-746.5kJ·mol-1,故答案:-746.5kJ·mol-1;
(2)①2NO(g)= N2O2(g) (快);②N2O2(g)+O2(g)=2NO2(g)(慢);而目标反应2NO(g) + O2(g)= 2NO2(g)的△H=①+②=△H1+△H2,由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正![]() v2正=v1逆
v2正=v1逆![]() v2逆,即k1正·c2(NO)
v2逆,即k1正·c2(NO)![]() k2正·c(N2O2)c(O2)=k1逆·c(N2O2)
k2正·c(N2O2)c(O2)=k1逆·c(N2O2)![]() k2逆
k2逆![]() k2逆·c2(NO2),K=
k2逆·c2(NO2),K=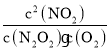 =
=![]() ,故答案:
,故答案:![]() ;
;
②由已知2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:Ⅰ.2NO(g)
2NO2(g)的反应历程分两步:Ⅰ.2NO(g) ![]() N2O2(g)(快);Ⅱ.N2O2(g)+O2(g)=2NO2(g)(慢),所以决定2NO(g)+O2(g)
N2O2(g)(快);Ⅱ.N2O2(g)+O2(g)=2NO2(g)(慢),所以决定2NO(g)+O2(g)![]() 2NO2(g)速率的是反应Ⅱ;因为决定2NO(g)+O2(g)= 2NO2(g)速率的是反应Ⅱ,所以反应Ⅰ的活化能E1远小于反应Ⅱ的活化能E2;决定反应速率的是反应Ⅱ,而温度越高k2正增大,反应速率加快,二氧化二氮的浓度减少,故C符合题意;故答案为:Ⅱ;<;C;
2NO2(g)速率的是反应Ⅱ;因为决定2NO(g)+O2(g)= 2NO2(g)速率的是反应Ⅱ,所以反应Ⅰ的活化能E1远小于反应Ⅱ的活化能E2;决定反应速率的是反应Ⅱ,而温度越高k2正增大,反应速率加快,二氧化二氮的浓度减少,故C符合题意;故答案为:Ⅱ;<;C;
(3)根据题干信息建立平衡三段式有:
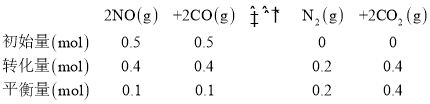
v(CO2)=![]() =0.05 mol/(L·min);因为一定温度下向容积为2L的密闭容器中加入0.5molNO、0.5molCO,此时容器总压为P0kPa,根据阿伏伽德罗定律,Kp=
=0.05 mol/(L·min);因为一定温度下向容积为2L的密闭容器中加入0.5molNO、0.5molCO,此时容器总压为P0kPa,根据阿伏伽德罗定律,Kp=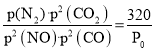 ;故答案:0.05;
;故答案:0.05;![]() ;
;
根据反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)可知:
N2(g)+2CO2(g)可知:
A.增大压强化学反应速率加快,平衡正向移动,提高NO的转化率,故A符合题意;
B.降低温度化学反应速率减慢,不符合题意,故B错误;
C.再加入0.5molNO、0.5molCO导致容器压强增大,化学反应速率加快,平衡正向移动,提高NO的转化率,故C符合题意;
D.分离出部分N2化学反应速率减慢,不符合题意,故D错误;
故答案选AC。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:Fe3+、Mg2+、SCN﹣、Cl﹣
B.c(H+)=10﹣12 molL﹣1的溶液中:K+、Na+、CO![]() 、NO
、NO![]()
C.c(Fe2+)=1 molL﹣1的溶液中:K+、NH![]() 、MnO
、MnO![]() 、SO
、SO![]()
D.能使甲基橙变红的溶液中:Na+、NH![]() 、SO
、SO![]() 、HCO
、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素包括氟、氯、溴、碘、砹等元素,位于元素周期表中第ⅦA族。
(1)画出下列卤族元素的原子结构示意图:①氟________;②氯________③溴________;④碘_________。
(2)比较卤族元素的原子结构:
①它们在结构上的相同点是____________;
②它们在结构上的不同点是_____________。
(3)卤族元素原子结构的变化规律是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.12 g铁粉加入到25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁粉剩余,溶液呈浅绿色,Cl-基本不变
B.向溶液中滴入无色硫氰化钾溶液,仍无色
C.溶液中Fe2+与Fe3+物质的量之比为6∶1
D.氧化产物与还原产物的物质的量之比为2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一整套电化学装置如右图,关于该装置说法正确的是( )
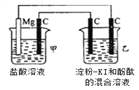
A. 甲池中Mg极为正极,电极反应式为:Mg-2e-═Mg2+
B. 甲池中C电极发生氧化反应
C. 乙池中将化学能转化为电能
D. 乙池左侧石墨电极附近变蓝,右侧石墨电极附近变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知t℃时,1L恒容密闭容器中发生如下反应:FeO(s)+CO(g) ![]() Fe(s)+CO2(g),该反应的平衡常数K=0.5,下列说法正确的是
Fe(s)+CO2(g),该反应的平衡常数K=0.5,下列说法正确的是
A.加入炭粉对该平衡无影响
B.将FeO(s)粉碎,不能缩短到达平衡所需的时间
C.t℃时,反应达到平衡后再充入CO,达新平衡后 n(CO):n(CO2)比值增大
D.若该容器中加入1molFeO(s),并通入1.8molCO, t℃时反应达到平衡,此时FeO(s)转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿的成分主要为 FeCr2O4 ,另含有少量 Al2O3 和 SiO2 。从铬铁矿中提取铁、铬的化合物,并获得副产物的工艺流程如下:
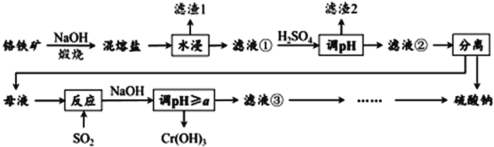
已知:铬铁矿FeCr2O4 中Cr元素在化合价为+3,“ 混熔盐 ” 中含有 Na2CrO4 和 NaFeO2 等成分,其中 NaFeO2 极易水解。试回答下列问题:
(1) “滤渣 1 ”为红褐色沉淀,其化学式为 _________________ ;
(2) 向滤液①中加 H2SO4 “调“ pH ”的目的:一是使 CrO![]() 转化为 Cr2O
转化为 Cr2O![]() ,离子方程式为 __________________ ;二是______________ 。
,离子方程式为 __________________ ;二是______________ 。
(3) “煅烧”铬铁矿时,主要成分反应的化学方程式为 _____________________ 。
(4) 根据下图溶解度(S)~温度(T) 曲线判断,

对滤液②进行的最佳“分离”方法为 ________( 填序号 ) 。
A. 蒸发结晶 B. 蒸发浓缩,趁热过滤 C. 蒸发浓缩,冷却结晶,过滤
(5) “反应”的离子方程式为 ____________________________ 。
(6) 已知 25 ℃时,Cr(OH) 3 的溶度积常数 Ksp [Cr(OH) 3 ]= 1.0 × 10 -32 。则使 Cr 3+恰好完全沉淀,即溶液中c(Cr 3+ )=1.0 × 10 -5 mol/L 时,应调节pH 的最小值a为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知由短周期元素构成的三种粒子:甲a(单核带一个单位正电荷)、乙I(四核不带电荷)、丙e(双核带一个单位负电荷),它们都有10个电子。物质A由甲、丙构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
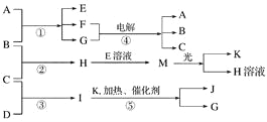
请填写下列空白:
(1)写出下列物质的化学式:B________,I________,J________。
(2) A的化学式是__________________。
(3)写出下列反应的离子方程式:
①H+E(溶液)→M_________________________________________________________。
②I溶于G________________________________________________________________。
(4)写出反应①的化学方程式_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Pd/A12O3是常见的汽车尾气催化剂。一种从废Pd/A12O3纳米催化剂(主要成分及含量:Pd0.3%,γ-A12O392.8%,其他杂质6.9%)中回收金属Pd的工艺如图:
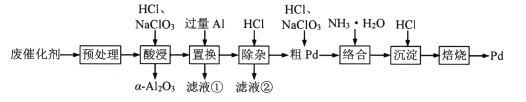
已知:γ-Al2O3能与酸反应,α-A12O3不与酸反应。
回答下列问题:
(1)“预处理”时,γ-A12O3经焙烧转化为α-A12O3,该操作的主要目的是___。
(2)“酸浸”时,Pd转化为PdCl![]() ,其离子方程式为___。
,其离子方程式为___。
(3)“滤液①”和“滤液②”中都含有的主要溶质有___(填化学式)。
(4)“粗Pd”溶解时,可用稀HNO3替代NaClO3,但缺点是___。两者相比,___(填化学式)的氧化效率更高(氧化效率以单位质量得到的电子数表示)。
(5)“沉淀”时,[Pd(NH3)4]2+转化为[Pd(NH3)2]Cl2沉淀,其化学方程式为___。
(6)酸性条件下,BrO3-能在负载Pd/A12O3纳米催化剂的电极表面快速转化为Br-。
①发生上述转化反应的电极应接电源的___极(填“正”或“负”);
②研究表明,电流密度越大,电催化效率越高;但当电流密度过大时,该电极会发生副反应生成___(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com