
【题目】Pd/A12O3是常见的汽车尾气催化剂。一种从废Pd/A12O3纳米催化剂(主要成分及含量:Pd0.3%,γ-A12O392.8%,其他杂质6.9%)中回收金属Pd的工艺如图:
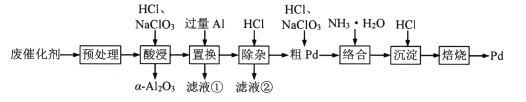
已知:γ-Al2O3能与酸反应,α-A12O3不与酸反应。
回答下列问题:
(1)“预处理”时,γ-A12O3经焙烧转化为α-A12O3,该操作的主要目的是___。
(2)“酸浸”时,Pd转化为PdCl![]() ,其离子方程式为___。
,其离子方程式为___。
(3)“滤液①”和“滤液②”中都含有的主要溶质有___(填化学式)。
(4)“粗Pd”溶解时,可用稀HNO3替代NaClO3,但缺点是___。两者相比,___(填化学式)的氧化效率更高(氧化效率以单位质量得到的电子数表示)。
(5)“沉淀”时,[Pd(NH3)4]2+转化为[Pd(NH3)2]Cl2沉淀,其化学方程式为___。
(6)酸性条件下,BrO3-能在负载Pd/A12O3纳米催化剂的电极表面快速转化为Br-。
①发生上述转化反应的电极应接电源的___极(填“正”或“负”);
②研究表明,电流密度越大,电催化效率越高;但当电流密度过大时,该电极会发生副反应生成___(填化学式)。
【答案】利于Pd与Al2O3的分离(或“大大减少了酸用量”,或“避免酸浸时氧化铝和酸发生反应”) 3Pd+![]() +6H++11Cl-=3
+6H++11Cl-=3![]() +3H2O AlCl3 对环境产生较大污染(或耗酸量大、或腐蚀性强、或氧化效率低) NaClO3 [Pd(NH3)4]Cl2+2HCl=[Pd(NH3)2]Cl2↓+2NH4Cl 负 H2
+3H2O AlCl3 对环境产生较大污染(或耗酸量大、或腐蚀性强、或氧化效率低) NaClO3 [Pd(NH3)4]Cl2+2HCl=[Pd(NH3)2]Cl2↓+2NH4Cl 负 H2
【解析】
废Pd/Al2O3纳米催化剂进行焙烧,使大量的γ-Al2O3经焙烧转化为α-A12O3,处理后,加入足量盐酸和NaClO3进行酸浸和氧化处理,Pd转化为![]() ,γ-Al2O3转化为Al3+后过滤,发生的离子反应为:3Pd+
,γ-Al2O3转化为Al3+后过滤,发生的离子反应为:3Pd+![]() +6H++11Cl-=3
+6H++11Cl-=3![]() +3H2O,Al2O3+6H+=2Al3++3H2O,α-A12O3不与酸反应,对酸浸后的溶液过滤,α-A12O3以滤渣的形式除去,得到含有
+3H2O,Al2O3+6H+=2Al3++3H2O,α-A12O3不与酸反应,对酸浸后的溶液过滤,α-A12O3以滤渣的形式除去,得到含有![]() 、Al3+的滤液,向滤液中加入过量的Al单质,将
、Al3+的滤液,向滤液中加入过量的Al单质,将![]() 置换为Pb单质,在进行过滤,得到主要含有Al3+、Cl-的滤液①,得到的固体主要含有Pb和过量的Al单质,再加入盐酸将过量的单质Al除去,再次过滤,得到主要含有Al3+、Cl-、H+的滤液②和粗Pd,向粗Pd中再次加入盐酸和NaClO3,将Pd溶解转化为
置换为Pb单质,在进行过滤,得到主要含有Al3+、Cl-的滤液①,得到的固体主要含有Pb和过量的Al单质,再加入盐酸将过量的单质Al除去,再次过滤,得到主要含有Al3+、Cl-、H+的滤液②和粗Pd,向粗Pd中再次加入盐酸和NaClO3,将Pd溶解转化为![]() ,向得到的溶液中加入氨水,将
,向得到的溶液中加入氨水,将![]() 转化为
转化为![]() ,再加入盐酸,使
,再加入盐酸,使![]() 转化为[Pd(NH3)2]Cl2沉淀,过滤后,对[Pd(NH3)2]Cl2进行焙烧生成高纯度的Pd单质,据此解答。
转化为[Pd(NH3)2]Cl2沉淀,过滤后,对[Pd(NH3)2]Cl2进行焙烧生成高纯度的Pd单质,据此解答。
(1)由于α-A12O3不与酸反应,“预处理”时,γ-Al2O3经焙烧转化为α-A12O3,该操作的主要目的是将大量的Al2O3在酸浸时以沉淀的形式除去,有利于Pd与Al2O3的分离,故答案为:有利于Pd与Al2O3的分离;
(2)根据分析,“酸浸”时,Pd转化![]() ,其离子方程式为3Pd+
,其离子方程式为3Pd+![]() +6H++11Cl-=3
+6H++11Cl-=3![]() +3H2O;
+3H2O;
(3)根据分析“滤液①”主要含有Al3+、Cl-,“滤液②”中主要含有Al3+、Cl-、H+,二者都含有的主要溶质有AlCl3,故答案为:AlCl3;
(4)“粗Pd”溶解时,可用稀HNO3替代NaClO3,但缺点是使用硝酸作氧化剂会生成氮氧化物,对环境产生较大污染(或耗酸量大、或腐蚀性强、或氧化效率低);63g硝酸为1mol做氧化剂转化为二氧化氮,转移1mol电子,即1g硝酸参与反应得到![]() 的电子,106.5gNaClO3为1mol,做氧化剂转化为
的电子,106.5gNaClO3为1mol,做氧化剂转化为![]() ,转移6mol电子,即1gNaClO3参与反应得到
,转移6mol电子,即1gNaClO3参与反应得到![]() 电子,两者相比,NaClO3的氧化效率更高,故答案为:对环境产生较大污染(或耗酸量大、或腐蚀性强、或氧化效率低);NaClO3;
电子,两者相比,NaClO3的氧化效率更高,故答案为:对环境产生较大污染(或耗酸量大、或腐蚀性强、或氧化效率低);NaClO3;
(5)“沉淀”时,![]() 转化为[Pd(NH3)2]Cl2沉淀,其化学方程式为[Pd(NH3)4]Cl2+2HCl=[Pd(NH3)2]Cl2↓+2NH4Cl;
转化为[Pd(NH3)2]Cl2沉淀,其化学方程式为[Pd(NH3)4]Cl2+2HCl=[Pd(NH3)2]Cl2↓+2NH4Cl;
(6)①BrO3-能在负载Pd/Al2O3纳米催化剂的电极表面快速转化为Br-,溴元素的化合价降低,得电子,发生还原反应,负载Pd/Al2O3纳米催化剂的电极作阴极,电解池的阴极与电源的负极相连,故答案为:负;
②电流密度越大,电催化效率越高;酸性条件下,但当电流密度过大时,进入到阴极的电子过多,多余的电子来不及被![]() 得到转化为Br-,电解质溶液中的氢离子会结合多余的电子,则出现电极副反应:2H++2e-=H2↑,故答案为:H2。
得到转化为Br-,电解质溶液中的氢离子会结合多余的电子,则出现电极副反应:2H++2e-=H2↑,故答案为:H2。


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)反应:N2(g)+O2(g)![]() 2NO(g) △H1=+180.5kJ·mol-1
2NO(g) △H1=+180.5kJ·mol-1
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H2。
N2(g)+2CO2(g) △H2。
已知CO的燃烧热为283.0 kJ·mol-1,则△H=_______________。
(2)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)![]() 2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)
2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
Ⅰ.2NO(g) ![]() N2O2(g)(快);v1正=k1正·c2(NO); v1逆=k1逆·c(N2O2) △H1<0
N2O2(g)(快);v1正=k1正·c2(NO); v1逆=k1逆·c(N2O2) △H1<0
Ⅱ.N2O2(g)+O2(g)=2NO2(g)(慢);v2正=k2正·c(N2O2)c(O2);v2逆=k2逆·c2(NO2) △H2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=_________。
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=_________。
②决定2NO(g)+O2(g)![]() 2NO2(g)速率的是反应_________(填“Ⅰ”或“Ⅱ”),反应Ⅰ的活化能E1与反应Ⅱ的活化能E2的大小关系为E1______E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是__________。
2NO2(g)速率的是反应_________(填“Ⅰ”或“Ⅱ”),反应Ⅰ的活化能E1与反应Ⅱ的活化能E2的大小关系为E1______E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是__________。
A.k2正增大,c(N2O2)增大 B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小 D.k2正减小,c(N2O2)增大
(3)在一定温度下向容积为2L的密闭容器中加入0.5molNO、0.5molCO,此时容器总压为P0kPa,发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),4min时达平衡,此时测得氮气的物质的量为0.2mol,则0-4min内用CO2表示的平均速率为_______mol·L-1·min-1,用平衡分压表示的平衡常数KP=__________(用含有P0的代数式表示)。达平衡后,若改变下列条件,既能加快反应速率又能提高NO的转化率的是____________
N2(g)+2CO2(g),4min时达平衡,此时测得氮气的物质的量为0.2mol,则0-4min内用CO2表示的平均速率为_______mol·L-1·min-1,用平衡分压表示的平衡常数KP=__________(用含有P0的代数式表示)。达平衡后,若改变下列条件,既能加快反应速率又能提高NO的转化率的是____________
A.增大压强 B.降低温度 C.再加入0.5molNO、0.5molCO D.分离出部分N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.NaHCO3的水解方程式:![]() +H2O
+H2O![]() H3O++
H3O++![]()
B.Fe2O3与HI充分反应:Fe2O3+6H+=2Fe3++3H2O
C.铜插入稀硝酸中:Cu+4H++2![]() =Cu2++2NO↑+H2O
=Cu2++2NO↑+H2O
D.NaClO溶液中通入少量的CO2:ClO-+CO2+H2O=HClO+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海中提取碘,某研究性学习小姐设计并进行了以下实验,请填写下列空白:

(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是___(用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是___,步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是__。
(3)步骤④反应的离子方程式是___。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是__、___。
(5)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性。回答下列问题:
(1)①H3PO2属于一元中强酸,酸性略强于亚硫酸,写出其电离方程式_________
②下列说法正确的是_________
A.NaH2PO2溶液显弱碱性
B.向NaH2PO2溶液中滴加硝酸可以制得H3PO2
C.1molH3PO2最多可以和3molNaOH发生反应
D.NaH2PO2溶液中:c(Na+)=c(H3PO2)+c(H2PO2-)
(2)H3PO2可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过):

①写出阳极反应式_________
②A、B、C分别是_________离子交换膜、_________离子交换膜、_________离子交换膜(填“阴”或“阳”)
③阳极室中溶液pH _________(填变大、变小或不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若含有1 mol铁离子和1 mol铝离子的混合溶液,现按下图横坐标依次加入8 mol 氢氧化钠溶液、1 mol盐酸,通入1 mol 二氧化碳气体,纵坐标为混合沉淀的物质的量。

(1)请画出沉淀的量随反应的变化曲线______________。
(2)并写出加入氢氧化钠6 mol及其后发生的各步反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氟酸为弱酸。25℃时将0.1mol·L-1的HF加水不断稀释,下列表示的量保持不变的是( )
①n(H+);②c(H+)·c(OH—);③c(OH—)+c(F—);④![]() ;⑤
;⑤![]() ;
;
A.①③④B.②③④C.③④⑤D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.不是所有的共价键都具有方向性
B.N≡N键能大于C≡C的键能,所以N≡N不易发生加成反应
C.根据价层电子对互斥理论可知,OF2分子的构型和H2O分子的构型相同
D.Na原子基态核外电子占有3个能层,4种能级,6个原子轨道,有6种电子运动状态
查看答案和解析>>
科目:高中化学 来源: 题型:
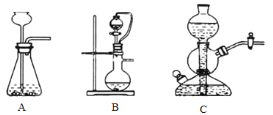
【题目】保险粉(Na2S2O4)可用作食品保鲜剂、纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇。在碱性介质中较稳定,在空气中易被氧化。锌粉法制备Na2S2O4的工艺流程如图所示:

回答下列问题:
(1)实验室可用浓硫酸和亚硫酸钠反应制取SO2,并希望能控制反应速度,图中可选用的发生装置是________(填字母)。
(2)工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是_________;步骤Ⅰ中发生反应的化学方程式为__________。
(3)步骤Ⅱ中需选用的玻璃仪器除了烧杯、玻璃棒之外,还有__________(填名称)。
(4)在步骤III中加入NaCl的作用是_______,得到的Na2S2O4固体要用乙醇洗涤,其优点是_________。
(5)铁氰化钾可用于分析检测保险粉。铁氰化钾K3[Fe(CN)6]是一种比较弱的氧化剂,其具有强氧化剂所没有的选择性氧化性,能将![]() 氧化为
氧化为![]() ,[Fe(CN)6]3还原为[Fe(CN)6]4,该反应的离子方程式为___________;取1.16g Na2S2O4样品溶于水,用0.4mol·L1的K3[Fe(CN)6]标准液滴定至终点,消耗25.00mL。该样品中Na2S2O4的质量分数为________。
,[Fe(CN)6]3还原为[Fe(CN)6]4,该反应的离子方程式为___________;取1.16g Na2S2O4样品溶于水,用0.4mol·L1的K3[Fe(CN)6]标准液滴定至终点,消耗25.00mL。该样品中Na2S2O4的质量分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com