
【题目】金属元素在自然界中分布很广,其中铜等在生产生活中有着广泛的应用.
(1)科学家通过X射线推测胆矾结构示意图如图1所示,①写出基态Cu原子的核外电子排布式;金属铜采用下列(填字母代号)堆积方式
②胆矾中含有的微粒间作用力有(填字母代号).
a.离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键
③铜离子形成胆矾中配离子的离子方程式为:;
(2)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac﹣表示CH3COO﹣),其反应是:[Cu(NH3)2]Ac+CO+NH3[Cu(NH3)3]Ac.CO[醋酸碳基三氨合铜(Ⅰ)]△H<0①C、N、O三种元素的第一电离能由小到大的顺序为
②氨分子中N原子的杂化方式为
(3)铜的化合物种类也很多,其常见价台为+1,+2价.如CuO、Cu2O、CuH等,如图2是同的一种氯化铜的晶胞结构,则它的化学式是 .
【答案】
(1)1s22s22p63s23p63d104s1或[Ar]3d104s1;C;abde;Cu2++4H2O=[Cu(H2O)4]2+
(2)C<O<N;sp3
(3)CuCl
【解析】解:(1)①Cu的原子序数为29,电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1 , Cu为最密堆积,配位数为12,C符合,所以答案是:1s22s22p63s23p63d104s1或[Ar]3d104s1;C;②根据胆矾晶体的结构图可知,在晶体中水分子与铜离子之间是配位键,氢氧之间是极性共价键,硫酸根和铜离子之间为离子键,水分子与水分子之间有氢键,所以答案是:abde;③铜离子与水分子通过配位键形成水合铜离子[Cu(H2O)4]2+ , 离子方程式为Cu2++4H2O=[Cu(H2O)4]2+ , 所以答案是:Cu2++4H2O=[Cu(H2O)4]2+;(2)①同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素,所以C、N、O三种元素的第一电离能由小到大的顺序为:C<O<N,所以答案是:C<O<N;②氨气中N原子的价层电子对数为 ![]() =4,所以N原子的杂化方式为sp3 , 所以答案是:sp3;(3)根据均摊法,可知晶胞中含Cl原子的个数为:8×
=4,所以N原子的杂化方式为sp3 , 所以答案是:sp3;(3)根据均摊法,可知晶胞中含Cl原子的个数为:8× ![]() +6×
+6× ![]() =4,Cu原子个数为4,所以氯原子和铜原子个数比为1:1,所以化学式为CuCl,所以答案是:CuCl;
=4,Cu原子个数为4,所以氯原子和铜原子个数比为1:1,所以化学式为CuCl,所以答案是:CuCl;


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是( )
A.1molFe与足量的Cl2反应转移的电子数为2NA
B.标准状况下,22.4L水中含有的水分子数为NA
C.常温、常压下,22gCO2中含有的氧原子数为NA
D.0.11mol/LCaCl2溶液中含氧离子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究工业废弃物的处理和防治具有重要的意义.
(1)利用反应CH4+2NO2 ![]() N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是 , 当消耗CH4的体积是11.2L(标准状况下)时,理论上可处理molNO2 .
N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是 , 当消耗CH4的体积是11.2L(标准状况下)时,理论上可处理molNO2 .
(2)治理汽车尾气中CO和NO的一种方法是:在汽车排气管中安装一个催化转化装置,该装置能将CO和NO转化为参与大气循环的无毒气体.该反应的化学方程式为
(3)某工厂排放的工业废水中可能含有Fe3+、Al3+、Cu2+ , 为了减少环境污染,变废为宝,利用废铁屑制得Fe2O3、Al2O3和金属Cu,过程如下.
①固体A的成分是 . (填化学式)
②溶液B中的阳离子有 .
③D与过量H溶液反应生成E的离子方程式是 .
④溶液E焰色呈黄色,试剂H是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是一种合成橡胶和树脂的重要原料,A是C、H、O三种元素组成的五元环状化合物,相对分子质量为98,其核磁共振氢谱只有一个峰;F的核磁共振氢谱有3个峰,峰面积之比为2:2:3.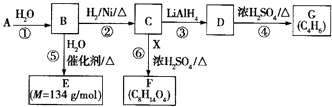
已知:  (其中R是烃基)
(其中R是烃基)
有关物质的转化关系如右图所示,请回答以下问题:
(1)A中不含氧的官能团的名称是;⑤的反应类型是 . G的结构简式为;G与Br2的CCl4溶液反应,产物有种(不考虑立体异构).
(2)反应②的化学方程式为 .
(3)E可在一定条件下通过(填反应类型)生成高分子化合物,写出该高分子化合物可能的结构简式:(两种即可).
(4)反应⑥的化学方程式为 .
(5)有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,写出所有符合条件的Y的结构简式: . Y与足量氢氧化钠溶液反应所得产物之一M,能与灼热的氧化铜反应,写出M与灼热的氧化铜反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保持期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是
A. 无水硫酸铜、蔗糖 B. 硅胶(具有吸湿性)、硫酸亚铁
C. 食盐、硫酸亚铁 D. 生石灰、食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用以下装置制取并探究氨气的性质.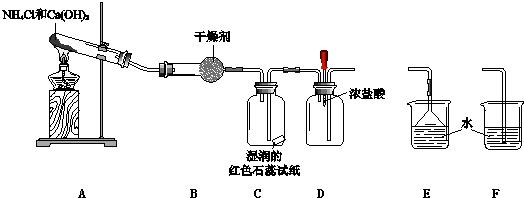
(1)A中反应的化学方程式是 .
(2)B中的干燥剂是 .
(3)C中的现象是 .
(4)实验进行一段时间后,挤压D装置中的胶头滴管,滴入1﹣2滴浓盐酸,可观察到的现象是 .
(5)为防止过量氨气外逸,需要在上述装置的末端增加一个尾气处理装置,应选用的装置是(填“E”或“F”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用图甲所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析,该同学改用图乙的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快.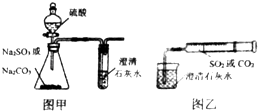
(1)若锥形瓶内装的是亚硫酸钠,写出锥形瓶内发生反应的化学方程式: .
(2)对比分析两组实验,你认为用图甲装置实验时,通入SO2不能出现浑浊的原因可能是 . 写出此时试管内发生反应的总化学方程式: .
(3)用图乙装置实验时,以相同速率通入CO2或SO2 , SO2产生浑浊再变澄清的现象比CO2快,其原因是 .
(4)用图甲进行SO2与澄清石灰水反应的实验时,为防止SO2污染空气,应用盛有过量浓烧碱溶液的容器吸收SO2 , 写出容器内发生反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把7.8g铝和镁的混合物粉末放入200mL盐酸中,恰好完全反应,并得到标准状况下8.96LH2 , 则:
(1)该合金中铝的物质的量为mol;
(2)该合金中镁的物质的量为g;
(3)盐酸的物质的量浓度为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列离子方程式中,不能用离子反应方程式 SO42-+Ba2+=BaSO4↓来表示的
A. Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 B. BaCl2 + Na 2SO4=BaSO4↓+ 2NaCl
C. Ba(OH)2+H2SO4=BaSO4↓+2H2O D. BaCl2 +H2SO4=BaSO4↓+2HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com