
【题目】把7.8g铝和镁的混合物粉末放入200mL盐酸中,恰好完全反应,并得到标准状况下8.96LH2 , 则:
(1)该合金中铝的物质的量为mol;
(2)该合金中镁的物质的量为g;
(3)盐酸的物质的量浓度为mol/L.
【答案】
(1)0.2
(2)2.4
(3)4
【解析】解:标况下8.96L氢气的物质的量为: ![]() =0.4mol, 设7.8g镁铝合金中含有镁xmol,含有铝ymol,则:
=0.4mol, 设7.8g镁铝合金中含有镁xmol,含有铝ymol,则:
Mg+2HCl=MgCl2+H2↑,
1 2 1
x 2x x
2Al+6HCl=2AlCl3+3H2↑,
2 6 3
y 3y ![]() y
y
根据合金质量及生成氢气的物质的量可知: 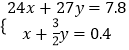 ,
,
解得:x=0.1、y=0.2,(1)根据分析可知,合金中Al的物质的量为0.2mol,所以答案是:0.2;(2)Mg的质量=0.1mol×24g/mol=2.4g,所以答案是:2.4g;(2)反应消耗的盐酸的总物质的量为:0.1mol×2+0.2mol×3=0.8mol,该盐酸的物质的量浓度为:c(HCl)= ![]() =4mol/L,所以答案是:4.
=4mol/L,所以答案是:4.


科目:高中化学 来源: 题型:
【题目】金属元素在自然界中分布很广,其中铜等在生产生活中有着广泛的应用.
(1)科学家通过X射线推测胆矾结构示意图如图1所示,①写出基态Cu原子的核外电子排布式;金属铜采用下列(填字母代号)堆积方式
②胆矾中含有的微粒间作用力有(填字母代号).
a.离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键
③铜离子形成胆矾中配离子的离子方程式为:;
(2)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac﹣表示CH3COO﹣),其反应是:[Cu(NH3)2]Ac+CO+NH3[Cu(NH3)3]Ac.CO[醋酸碳基三氨合铜(Ⅰ)]△H<0①C、N、O三种元素的第一电离能由小到大的顺序为
②氨分子中N原子的杂化方式为
(3)铜的化合物种类也很多,其常见价台为+1,+2价.如CuO、Cu2O、CuH等,如图2是同的一种氯化铜的晶胞结构,则它的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.按照系统命名法,烃分子  的名称为2,3﹣二甲基﹣3﹣乙基戊烷
的名称为2,3﹣二甲基﹣3﹣乙基戊烷
B.鸡蛋白、大豆蛋白等蛋白质可溶于水,在这些蛋白质溶液中加入(NH4)2SO4或Na2SO4的浓溶液,可使蛋白质的溶解度降低而析出
C.![]() 可发生加成反应、取代反应、氧化反应
可发生加成反应、取代反应、氧化反应
D.有机物 ![]() (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应
(俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有浓度均为1 mol·L-1的下列4种溶液:
①H2SO4溶液②NaHCO3溶液③NH4Cl溶液④NaOH溶液
(1)这4种溶液pH由大到小的顺序是 ,其中由水电离的H+浓度最小的是 。(均填序号)
(2)②中各离子浓度由大到小的顺序是 ,NaHCO3的水解平衡常数Kh= mol·L-1。(已知碳酸的电离常数K1=4×10-7,K2=5.6×10-11)
(3)向③中通入少量氨气,此时![]() 的值 (填“增大”、“减小”或“不变”)。
的值 (填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积 ④的体积(填“大于”、“小于”或“等于”之一)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.利用石蜡油在碎瓷片上分解可得纯净的乙烯
B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
C.苯可使溴水褪色,是发生了取代反应
D.C4H9Cl有4种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有关实验事实的说明或解释正确的是( )
A.浓硫酸和浓盐酸长期暴露在空气中浓度都会降低,但原理不相同
B.常温下,浓硫酸可以用铁制容器储存,说明铁与冷的浓硫酸不反应
C.向某溶液中加入盐酸酸化的氯化钡溶液,生成白色沉淀,说明原溶液中一定含有SO ![]()
D.向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,又是合成氨工业的重要原料.
(1)已知:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=206.2kJmol﹣1CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=247.4kJmol﹣1
甲烷和H2O(g)反应生成H2和CO2的热化学方程式为 .
(2)工业合成氨的反应原理为N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJmol﹣1 . 某温度下,把10mol N2与28mol H2置于容积为10L的密闭容器内,10min时反应达到平衡状态,测得氮气的平衡转化率为60%,则10min内该反应的平均速率v(H2)=molL﹣1min﹣1 , 则该温度下该反应的平衡常数K= . 欲增大氮气的平衡转化率,可采取的措施有(写一种措施即可).
(3)如图所示装置工作时均与H2有关. 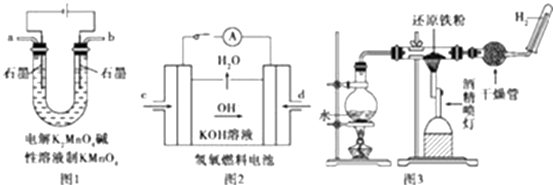
①图1所示装置中阳极的电极反应式为
②图2所示装置中,通入H2的管口是(选填字母代号).
③某同学按图3所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色.该同学据此得出结论:铁与水蒸气反应生成FeO和H2 . 该结论(填“严密”或“不严密”),你的理由是(用离子方程式和必要的文字说明).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com