
【题目】氢气是一种清洁能源,又是合成氨工业的重要原料.
(1)已知:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=206.2kJmol﹣1CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=247.4kJmol﹣1
甲烷和H2O(g)反应生成H2和CO2的热化学方程式为 .
(2)工业合成氨的反应原理为N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJmol﹣1 . 某温度下,把10mol N2与28mol H2置于容积为10L的密闭容器内,10min时反应达到平衡状态,测得氮气的平衡转化率为60%,则10min内该反应的平均速率v(H2)=molL﹣1min﹣1 , 则该温度下该反应的平衡常数K= . 欲增大氮气的平衡转化率,可采取的措施有(写一种措施即可).
(3)如图所示装置工作时均与H2有关. 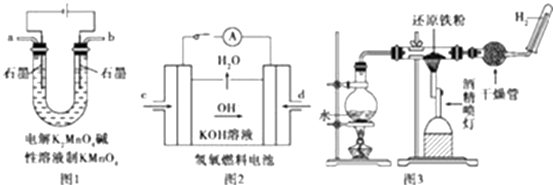
①图1所示装置中阳极的电极反应式为
②图2所示装置中,通入H2的管口是(选填字母代号).
③某同学按图3所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色.该同学据此得出结论:铁与水蒸气反应生成FeO和H2 . 该结论(填“严密”或“不严密”),你的理由是(用离子方程式和必要的文字说明).
【答案】
(1)CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165.0kJ/mol
(2)0.18;3.6;增加氢气的浓度或分离出氨气或降温
(3)MnO42﹣﹣e﹣=MnO4﹣;d;不严密;产物中含+3价铁的物质与稀硫酸反应后生成Fe3+ , Fe3+可与过量的Fe反应生成Fe2+:2Fe3++Fe=3Fe2+
【解析】解:(1.)CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ/mol① CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4kJ/mol②
将方程式①×2﹣②得CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165.0kJ/mol,
所以答案是:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165.0kJ/mol;
(2.)转化的氮气的物质的量=10mol×60%=6mol,则10min内的平均反应速率v(N2)= ![]() =0.06mol/L.min,同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以v(H2)=0.18mol/L.min;
=0.06mol/L.min,同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以v(H2)=0.18mol/L.min;
反应达到平衡状态时,C(N2)= ![]() =0.4mol/L,C(H2)=
=0.4mol/L,C(H2)= ![]() mol/L,
mol/L,
C(NH3)= ![]() =1.2mol/L,则K=
=1.2mol/L,则K= ![]() =3.6(mol/L) ﹣2;
=3.6(mol/L) ﹣2;
该反应是一个反应前后气体体积减小的放热反应,增加反应物或减小生成物的浓度或降低温度都能使反应向正反应方向移动,所以增加氢气的浓度或分离出氨气或降温都能使该反应向正反应方向移动,
所以答案是:0.18;3.6;增加氢气的浓度或分离出氨气或降温;
(3.)①阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为:MnO42﹣﹣e﹣=MnO4﹣ .
所以答案是:MnO42﹣﹣e﹣=MnO4﹣;
②氢氧燃料碱性电池中,氢气失电子和氢氧根离子反应生成水,图片中氢氧根离子向d电极移动,说明d电极上是氢气,
所以答案是:d;
③铁和水蒸气在高温下反应生成四氧化三铁和氢气,根据反应现象知,该反应中部分铁未参加反应导致剩余的铁和铁离子反应生成二价铁离子,离子方程式为:2Fe3++Fe=3Fe2+ , 所以说不严密,
所以答案是:不严密; 产物中含+3价铁的物质与稀硫酸反应后生成Fe3+ , Fe3+可与过量的Fe反应生成Fe2+:2Fe3++Fe=3Fe2+ .
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】把7.8g铝和镁的混合物粉末放入200mL盐酸中,恰好完全反应,并得到标准状况下8.96LH2 , 则:
(1)该合金中铝的物质的量为mol;
(2)该合金中镁的物质的量为g;
(3)盐酸的物质的量浓度为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列离子方程式中,不能用离子反应方程式 SO42-+Ba2+=BaSO4↓来表示的
A. Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 B. BaCl2 + Na 2SO4=BaSO4↓+ 2NaCl
C. Ba(OH)2+H2SO4=BaSO4↓+2H2O D. BaCl2 +H2SO4=BaSO4↓+2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质有关的叙述正确的是
A.苯、油脂均不能使酸性KMnO4溶液褪色
B.聚酯纤维、有机玻璃、光导纤维都属于有机高分子材料
C.乙醇可以被氧化为乙酸,二者都能发生取代反应
D.淀粉和蛋白质均可作为生产葡萄糖的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1)生活中明矾常作净水剂,其净水的原理是________________________(用离子方程式表示)。
(2)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理________________________。
(3)去年8月12日晚,天津滨海新区危险品仓库发生爆炸事故,少量氰化物因爆炸冲击发生泄漏,CN一有剧毒,泄露会污染水源和空气,需要处理。
①已知HCN为一元弱酸,则NaCN溶液的pH _____________7(填“>”“=”或“<”),用离子方程式说明_____________________________。
②处理含CN一废水的方法之一是在微生物的作用下,CN-被氧气氧化成HCO3一,同时生成NH3,该反应的离子方程式为___________________________________________________。
(4)常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得溶液混合后的pH=5,写出MOH的电离方程式:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.稀硫酸与氢氧化钡溶液混合:Ba2++SO ![]() +OH﹣+H+═H2O+BaSO4↓
+OH﹣+H+═H2O+BaSO4↓
B.Cl2通入水中:Cl2+H2O═H++Cl﹣+HClO
C.将钠加入硫酸铜溶液中的反应:2Na+2Cu2+═2Na++Cu
D.铜片投入稀硫酸中:Cu+2H+═Cu2++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 向0.1 molL-1CH3COOH溶液中加入少量水,溶液中 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中  增大
增大
C. 向盐酸中加入氨水至中性,溶液中 >1
>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3溶液中 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成下面题目:
(1)由于钠很容易与空气中的二氧化碳和等物质反应,所以钠在自然界里只能以态存在.
(2)维生素C又称为抗坏血酸,在人体内有重要的功能.例如帮助人体将食物中摄取的不易吸收的Fe3+变为易吸收的Fe2+ . 这说明维生素C具有(填氧化性或还原性).
(3)写出下列空格内物质的名称、俗名或化学式:
名称 | 氧化铁 | 碳酸钠 | 碳酸氢钠 |
俗名 | 铁红 | 小苏打 | |
化学式 | Na2CO3 | NaHCO3 |
(4)写出下列电离方程式或化学方程式:①Na2CO3在水溶液中的电离方程式②曾青(CuSO4)得铁化为铜的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,m g A气体与n g B气体分子数相等,下列说法不正确的是( )
A.标准状况下,同体积的气体A和气体B的质量比m:n
B.25℃时,1kg气体A与1kg气体B的分子数之比为n:m
C.同温同压下,气体A与气体B的密度之比为m:n
D.标准状况下,等质量的A与B的体积比为m:n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com