
【题目】根据要求回答下列问题:
(1)生活中明矾常作净水剂,其净水的原理是________________________(用离子方程式表示)。
(2)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理________________________。
(3)去年8月12日晚,天津滨海新区危险品仓库发生爆炸事故,少量氰化物因爆炸冲击发生泄漏,CN一有剧毒,泄露会污染水源和空气,需要处理。
①已知HCN为一元弱酸,则NaCN溶液的pH _____________7(填“>”“=”或“<”),用离子方程式说明_____________________________。
②处理含CN一废水的方法之一是在微生物的作用下,CN-被氧气氧化成HCO3一,同时生成NH3,该反应的离子方程式为___________________________________________________。
(4)常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得溶液混合后的pH=5,写出MOH的电离方程式:____________________________________________。
【答案】 Al3+ +3H2O![]() Al(OH)3 + 3H+ MgO+2NH4Cl+H2O = MgCl2+2 NH3·H2O或NH4Cl+H2O
Al(OH)3 + 3H+ MgO+2NH4Cl+H2O = MgCl2+2 NH3·H2O或NH4Cl+H2O ![]() NH3·H2O+HCl,MgO+2HCl=MgCl2+H2O > CN-+H2O=HCN + OH- 2CN-+4H2O+O2=2HCO3- + 2NH3 MOH
NH3·H2O+HCl,MgO+2HCl=MgCl2+H2O > CN-+H2O=HCN + OH- 2CN-+4H2O+O2=2HCO3- + 2NH3 MOH![]() M++OH-
M++OH-
【解析】本题考查盐类的水解相关知识。(1)明矾溶于水电离出铝离子,铝离子易水解生成氢氧化铝胶体,胶体具有吸附性,能吸附水中的悬浮物而净水,所以明矾能净水,离子方程式为Al3+ +3H2O![]() Al(OH)3 + 3H+;(2)氯化铵溶液中铵根离子水解:NH4Cl+H2O
Al(OH)3 + 3H+;(2)氯化铵溶液中铵根离子水解:NH4Cl+H2O![]() NH3·H2O+HCl,溶液呈酸性,氧化镁和水解生成的盐酸反应生成氯化镁,方程式为:MgO+2NH4Cl+H2O = MgCl2+2 NH3·H2O或NH4Cl+H2O
NH3·H2O+HCl,溶液呈酸性,氧化镁和水解生成的盐酸反应生成氯化镁,方程式为:MgO+2NH4Cl+H2O = MgCl2+2 NH3·H2O或NH4Cl+H2O ![]() NH3·H2O+HCl,MgO+2HCl=MgCl2+H2O;(3)①HCN为一元弱酸,则NaCN为强碱弱酸盐,能发生水解:CN-+H2O
NH3·H2O+HCl,MgO+2HCl=MgCl2+H2O;(3)①HCN为一元弱酸,则NaCN为强碱弱酸盐,能发生水解:CN-+H2O![]() HCN + OH-,溶液呈碱性,故pH>7;②根据题中信息CN-被氧气氧化成HCO3一同时生成NH3,结合氧化还原反应配平即得:2CN-+4H2O+O2=2HCO3- + 2NH3;(4)常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,说明HCl与MOH的物质的量相等,二者恰好完全反应,生成MCl,测得溶液混合后的pH=5,说明MCl为强酸弱碱盐,能水解呈酸性,即MOH
HCN + OH-,溶液呈碱性,故pH>7;②根据题中信息CN-被氧气氧化成HCO3一同时生成NH3,结合氧化还原反应配平即得:2CN-+4H2O+O2=2HCO3- + 2NH3;(4)常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,说明HCl与MOH的物质的量相等,二者恰好完全反应,生成MCl,测得溶液混合后的pH=5,说明MCl为强酸弱碱盐,能水解呈酸性,即MOH![]() M++OH-。
M++OH-。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.按照系统命名法,烃分子  的名称为2,3﹣二甲基﹣3﹣乙基戊烷
的名称为2,3﹣二甲基﹣3﹣乙基戊烷
B.鸡蛋白、大豆蛋白等蛋白质可溶于水,在这些蛋白质溶液中加入(NH4)2SO4或Na2SO4的浓溶液,可使蛋白质的溶解度降低而析出
C.![]() 可发生加成反应、取代反应、氧化反应
可发生加成反应、取代反应、氧化反应
D.有机物 ![]() (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应
(俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法命名或写出结构简式:
(1)3-甲基-2-丙基-1-戊烯的结构简式为______________________________
(2)![]() 名称为_______________________________________
名称为_______________________________________
(3)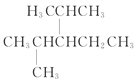 名称为:________________________________
名称为:________________________________
(4)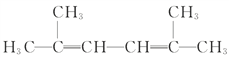 名称为:_______________
名称为:_______________
(5)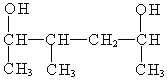 名称为:___________________________
名称为:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是( )
A. pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol·L-1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的乙二酸(H2C2O4)溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
D. pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3 , 含少量FeCO3)为原料制备高纯氧化镁的实验流程如下: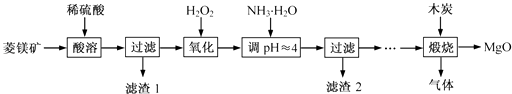
(1)MgCO3与稀硫酸反应的离子方程式为 .
(2)加入H2O2 氧化时,发生反应的化学方程式为 .
(3)滤渣2 的成分是(填化学式).
(4)煅烧过程存在以下反应:2MgSO4+C ![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C ![]() MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C ![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集.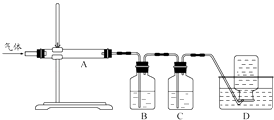
①D中收集的气体可以是(填化学式).
②B中盛放的溶液可以是(填字母).
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,又是合成氨工业的重要原料.
(1)已知:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=206.2kJmol﹣1CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=247.4kJmol﹣1
甲烷和H2O(g)反应生成H2和CO2的热化学方程式为 .
(2)工业合成氨的反应原理为N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJmol﹣1 . 某温度下,把10mol N2与28mol H2置于容积为10L的密闭容器内,10min时反应达到平衡状态,测得氮气的平衡转化率为60%,则10min内该反应的平均速率v(H2)=molL﹣1min﹣1 , 则该温度下该反应的平衡常数K= . 欲增大氮气的平衡转化率,可采取的措施有(写一种措施即可).
(3)如图所示装置工作时均与H2有关. 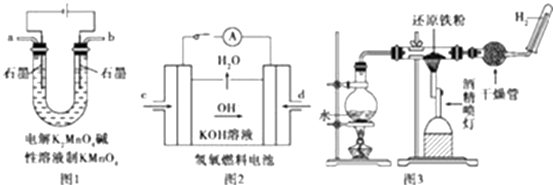
①图1所示装置中阳极的电极反应式为
②图2所示装置中,通入H2的管口是(选填字母代号).
③某同学按图3所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色.该同学据此得出结论:铁与水蒸气反应生成FeO和H2 . 该结论(填“严密”或“不严密”),你的理由是(用离子方程式和必要的文字说明).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(I)甲烷在一定条件下可生成以下微粒:
A.碳正离子(CH3+ ) B.碳负离子(CH3﹣) C.甲基 (﹣CH3) D.碳烯(:CH2)
①四种微粒中,键角为120°的是(填序号).
②碳负离子(CH3﹣)的空间构型为 , 与CH3﹣互为等电子体的一种分子是(填化学式).
(II )在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学方程式为(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac.请回答下列问题:
①C、N、O的电负性由大到小的顺序为 .
②写出Cu的核外电子排布式 .
③化合物Cu(NH3)3(CO)Ac中,金属元素的化合价为 .
④在一定条件下NH3和CO2能合成尿素CO(NH2)2 , 尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为 .
⑤Cu2O晶体的晶胞结构如图所示,若阿伏伽德罗常数为NA , 晶胞的边长为apm,则晶体的密度为gcm﹣3 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5L某浓度的NaCl溶液中含有0.5mol Na+ , 下列对该溶液的说法中,不正确的是( )
A.该溶液的物质的量浓度为1molL﹣1
B.该溶液中含有58.5g NaCl
C.配制100mL该溶液需用5.85g NaCl
D.量取100mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( ) ①将金属Na投入水中:2Na+2H2O=2Na++2OH﹣+H2↑
②在硫酸溶液中加入氢氧化钡溶液至中性:Ba2++OH﹣+H++SO ![]() =BaSO4↓+H2O
=BaSO4↓+H2O
③碳酸氢钙溶液中滴加盐酸:HCO ![]() +H+=CO2↑+H2O
+H+=CO2↑+H2O
④碳酸钙中滴加盐酸:CO ![]() +2H+=CO2↑+H2O.
+2H+=CO2↑+H2O.
A.①③④
B.①③
C.②④
D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com