
【题目】下列叙述正确的是( )
①锌跟稀硫酸反应制H2,加入少量硫酸铜溶液能加快反应速率
②镀层破损后,白口铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀
③电镀时,应把镀件置于电解槽的阴极
④冶炼铝时,把氧化铝加入液态冰晶石中熔融后电解
⑤钢铁表面常易腐蚀生成Fe2O3·nH2O
A.全部B.①③④⑤C.①②⑤D.②④
【答案】B
【解析】
① 锌可以置换出铜,形成原电池,原电池反应比一般化学反应的速率快;
② 金属越活泼越易腐蚀;
③ 电镀时,镀件金属置于电解槽的阴极,镀层金属为电解槽的阳极;
④ 电解氧化铝,为了降低其熔点,用冰晶石(![]() );
);
⑤ 铁锈的主要成分(![]() )。
)。
① 锌与硫酸铜溶液发生置换反应,其离子反应方程式为:![]() ,形成原电池,加快反应速率,①正确;
,形成原电池,加快反应速率,①正确;
② 金属活动性:![]() ,镀层破损后,白口铁(镀锌的铁)中
,镀层破损后,白口铁(镀锌的铁)中![]() 为原电池的负极,仍能保护
为原电池的负极,仍能保护![]() ,而马口铁(镀锡的铁)中
,而马口铁(镀锡的铁)中![]() 为原电池的负极,加快
为原电池的负极,加快![]() 的腐蚀,马口铁(镀锡的铁)比白口铁(镀锌的铁)更易腐蚀,②错误;
的腐蚀,马口铁(镀锡的铁)比白口铁(镀锌的铁)更易腐蚀,②错误;
③ 电镀时,镀件金属为电解池的阴极,镀层金属为电解池的阳极,在阴极上析出镀层金属,③正确;
④ 冶炼金属铝,电解熔融的氧化铝,为了降低其熔点,氧化铝加入液态冰晶石(![]() )熔融后电解;④正确;
)熔融后电解;④正确;
⑤ 钢铁表面常因发生原电池而被腐蚀,由于![]() 比杂质
比杂质![]() 活泼,所以
活泼,所以![]() 作原电池的负极被氧化,最终得到铁锈(
作原电池的负极被氧化,最终得到铁锈(![]() ),⑤正确。
),⑤正确。
因此正确的是:①③④⑤。


科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这四种溶液的阴离子结合质子能力最强的是______。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与浓度相等的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号)_____。
③向NaCN溶液通入少量CO2反应的化学方程式是_______。
(2)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是____,此时, =_____。
=_____。
(3)常温下,向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
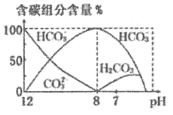
回答下列问题:
在同一溶液中H2CO3、![]() 、
、![]() ______(填“能”或“不能”)大量共存。
______(填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的主要微粒为_____,溶液中各种离子(![]() 除外)的物质的量浓度的大小关系为______。
除外)的物质的量浓度的大小关系为______。
③已知在25℃时,![]() 水解反应的平衡常数即水解常数Kh=
水解反应的平衡常数即水解常数Kh=![]() =2.0×10-4,当溶液中c(
=2.0×10-4,当溶液中c(![]() ):c(
):c(![]() )=2:1时,溶液pH=______。
)=2:1时,溶液pH=______。
(4)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可提取多种化工原料,下面是工业上对海水成分综合利用的示意图。
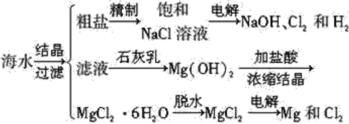
试回答下列问题:
(1)写出用海滩上的贝壳制Ca(OH)2的化学方程式_________________________。
(2)写出电解饱和NaCl溶液的化学方程式___________________________________。
(3)将电解生成的氯气通入石灰乳中可制得漂白粉,写出其反应的化学方程式_______________________。
(4)用海滩上的贝壳制Ca(OH)2而不从异地山中开凿石灰石制取,主要考虑到什么问题?_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X的蒸气相对氢气的密度为51,X中氧元素的质量分数为31.5%,则能与NaOH溶液发生反应的X的同分异构体有(不考虑立体异构)( )
A. 15种B. 14种C. 13种D. 12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I .含碳原子数最少且存在同分异构体的烷烃的分子式是_____,其同分异构体的结构简式是________。
II.从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)B的结构简式______。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:______________,反应类型:________。
(3)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:______________________,反应类型:________。
III.已知乙烯能发生以下转化:

(1)C中含官能团名称_________;
(2)写出B与D反应的化学方程式_______________________;反应类型:________。
(3)写出反应③的化学方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①在X极附近观察到的现象是_________________________________________。
②Y电极上的电极反应式为___________________________________。
(2)如用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是_______,电极反应式为__________________________。
②Y电极的材料是_______
(3)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
①该电解槽的阳极反应式是_____________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因________________。
③除去杂质后的氢氧化钾溶液从溶液出口________(填写“A”或“B”)导出。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机制药工业中常用以下方法合成一种药物中间体(G):


(1)G的分子式是___。
(2)化合物A中含氧官能团的名称为___。
(3)由C→D的反应类型为___;化合物E的结构简式为___。
(4)写出B→C的反应的化学方程式:___。
(5)写出同时满足下列条件的B的一种同分异构体的结构简式:___。
①能与新制Cu(OH)2在加热条件下反应生成砖红色沉淀,水解产物之一能与FeCl3溶液发生显色反应;
②核磁共振氢谱为四组峰,峰面积比为1∶2∶4∶9;
③分子中含有氨基。
(6)已知:RCN![]() RCH2NH2,请写出以HOOCCH2CH2COOH和CH3CH2Cl为原料制备
RCH2NH2,请写出以HOOCCH2CH2COOH和CH3CH2Cl为原料制备![]() 的合成路线流程图___(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图___(无机试剂任用)。合成路线流程图示例如下:
CH3CH2OH![]() CH2
CH2![]() CH2
CH2![]() CH3CH2Cl
CH3CH2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CMU是一种荧光指示剂,可通过下列反应制备:
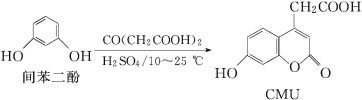
下列说法正确的是( )
A.1 mol CMU最多可与4 mol Br2反应
B.1 mol CMU最多可与4 mol NaOH反应
C.可用FeCl3溶液鉴别间苯二酚和CMU
D.CMU在酸性条件下的水解产物只有1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构为如图所示,关于这种有机物不正确的说法有
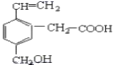
①该物质分子式为C11H12O3,能溶于水;
②能使溴水、酸性KMnO4溶液褪色,且原理相同;
③分别与Na、NaHCO3反应两者生成气体的物质的量之比均是1:1;
④能发生取代、加成、水解、氧化、还原反应
A.1种B.2种C.3种D.4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com