
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这四种溶液的阴离子结合质子能力最强的是______。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与浓度相等的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号)_____。
③向NaCN溶液通入少量CO2反应的化学方程式是_______。
(2)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是____,此时, =_____。
=_____。
(3)常温下,向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
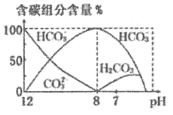
回答下列问题:
在同一溶液中H2CO3、![]() 、
、![]() ______(填“能”或“不能”)大量共存。
______(填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的主要微粒为_____,溶液中各种离子(![]() 除外)的物质的量浓度的大小关系为______。
除外)的物质的量浓度的大小关系为______。
③已知在25℃时,![]() 水解反应的平衡常数即水解常数Kh=
水解反应的平衡常数即水解常数Kh=![]() =2.0×10-4,当溶液中c(
=2.0×10-4,当溶液中c(![]() ):c(
):c(![]() )=2:1时,溶液pH=______。
)=2:1时,溶液pH=______。
(4)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为________mol/L。
【答案】Na2CO3 b>a>c NaCN+H2O+CO2=NaHCO3+HCN CNˉ+H2OHCN+OHˉ 2 不能 ![]() 、H2CO3 c(Na+)>c(Clˉ)>c(
、H2CO3 c(Na+)>c(Clˉ)>c(![]() )>c(H+)=c(OHˉ) 10 5.6×10-5mol/L
)>c(H+)=c(OHˉ) 10 5.6×10-5mol/L
【解析】
(1)①已知酸的酸性强弱顺序为HCOOH>H2CO3>HCN>NaHCO3,所以对应酸根结合H+能力强弱的顺序为![]() >CNˉ>
>CNˉ>![]() >HCOOˉ,故Na2CO3结合H+能力最强;
>HCOOˉ,故Na2CO3结合H+能力最强;
②酸性强弱顺序为H2SO4>HCOOH>HCN,HCOOH和HCN是弱酸,所以c(H+)相同的三种酸浓度c(HCN)>c(HCOOH)>c(H2SO4),所以同浓度的NaOH溶液完全中和体积相同、c(H+)相同的三种酸,所消耗NaOH溶液的体积由大到小的排列顺序为b>a>c;
③因为酸性强弱H2CO3>HCN>NaHCO3,向NaCN溶液通入少量CO2应生成HCN和NaHCO3,可知NaCN溶液和CO2反应的方程式为NaCN+CO2+H2O=NaHCO3+HCN;
(2)HCN是弱酸,所以NaCN为强碱弱酸盐,溶液中存在CNˉ的水解使溶液显酸性,离子方程式为CNˉ+H2OHCN+OHˉ;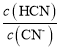 =
=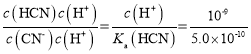 =2;
=2;
(3)①由图可知,pH在8~12只存在![]() 、
、![]() ,pH<8只存在H2CO3、
,pH<8只存在H2CO3、![]() ,可知同一溶液中,
,可知同一溶液中,![]() 可分别于H2CO3、
可分别于H2CO3、![]() 共存,但H2CO3和
共存,但H2CO3和![]() 不能大量共存;
不能大量共存;
②据图可知pH=7时溶液中含碳元素的主要微粒为![]() 、H2CO3;pH=7时c(H+)=c(OHˉ),溶液中存在电荷守恒c(Na+)+c(H+)=c(Clˉ)+c(
、H2CO3;pH=7时c(H+)=c(OHˉ),溶液中存在电荷守恒c(Na+)+c(H+)=c(Clˉ)+c(![]() )+c(OHˉ)+2c(
)+c(OHˉ)+2c(![]() ),所以c(Na+)=c(Clˉ)+c(
),所以c(Na+)=c(Clˉ)+c(![]() )+2c(
)+2c(![]() ),则c(Na+)>c(Clˉ);当加入20mLHCl时,溶液中的溶质为等物质的量的NaHCO3和NaCl,此时溶液显碱性,则呈中性时需要继续滴加HCl溶液,所以当pH=7时c(Clˉ)>c(
),则c(Na+)>c(Clˉ);当加入20mLHCl时,溶液中的溶质为等物质的量的NaHCO3和NaCl,此时溶液显碱性,则呈中性时需要继续滴加HCl溶液,所以当pH=7时c(Clˉ)>c(![]() ),所以溶液中各种离子(
),所以溶液中各种离子(![]() 除外)的物质的量浓度的大小关系为c(Na+)>c(Clˉ)>c(
除外)的物质的量浓度的大小关系为c(Na+)>c(Clˉ)>c(![]() )>c(H+)=c(OHˉ);
)>c(H+)=c(OHˉ);
③当溶液中c(![]() ):c(
):c(![]() )=2:1时,c(OHˉ)=
)=2:1时,c(OHˉ)=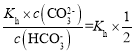 =1.0×10-4mol/L,则此时溶液中c(H+)=1×10-10mol/L,溶液的pH为10;
=1.0×10-4mol/L,则此时溶液中c(H+)=1×10-10mol/L,溶液的pH为10;
(4)浓度为2×10-4mol/LNa2CO3溶液与CaCl2溶液等体积混合后溶液中c(![]() )=1.0×10-4mol/L,若产生沉淀,则钙离子浓度最小为c(Ca2+)=
)=1.0×10-4mol/L,若产生沉淀,则钙离子浓度最小为c(Ca2+)=![]() =2.8×10-5mol/L,则原氯化钙溶液的浓度至少为5.6×10-5mol/L。
=2.8×10-5mol/L,则原氯化钙溶液的浓度至少为5.6×10-5mol/L。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲制备摩尔盐[(NH4)2Fe(SO4)2·6H2O]并探究其分解产物。查到如下信息:
摩尔盐可由FeSO4溶液与(NH4)2SO4溶液混合制备;该物质能溶于水、不溶于乙醇,在空气中能逐渐被氧化;100℃开始分解,且分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。
I.制备摩尔盐
(1)向新制的FeSO4溶液中加入(NH4)2SO4固体,加热,实验过程中最好采用___________加热方式。
(2)蒸发浓缩、冷却结晶使摩尔盐结晶析出,晶体过滤后用_____________洗涤。
(3)该小组用滴定法测产品纯度。现称取a g该产品于锥形瓶中,加蒸馏水溶解,用0.1000mol/L酸性KMnO4溶液滴定,到达滴定终点时,消耗KMnO4溶液20.00 mL,则该产品的纯度为____________。
II.探究摩尔盐受热分解的产物
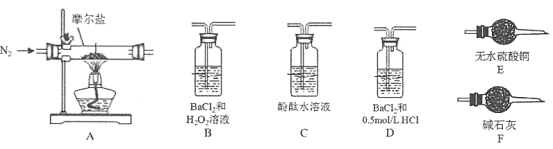
(4)验证分解产物中含有氨气和水蒸气,并探究残留固体成分。
①所选用装置的正确连接顺序为___________。(可选部分仪器,填装置的字母序号)
②A中固体完全分解后变为红棕色粉末,设计实验证明A中残留固体仅为Fe2O3,而不含FeO或Fe3O4______________________。
(5)探究分解产物中的硫氧化物,按A-D-B-F的顺序连接装置,进行实验。
①D装置中试剂的作用是____________________________________________。
②实验过程中,仅B中有沉淀生成,其他实验证明摩尔盐受热分解除上述产物外,还有N2生成。写出摩尔盐受热分解的化学方程式__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备流程如下:
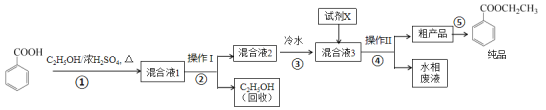
试剂相关性质如下表:
苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
常温性状 | 白色针状晶体 | 无色液体 | 无色透明液体 |
沸点/℃ | 249.0 | 78.0 | 212.6 |
相对分子量 | 122 | 46 | 150 |
溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
回答下列问题:
(1)为提高原料苯甲酸的纯度,可采用的纯化方法为_________。
(2)步骤①的装置如图所示(加热和夹持装置已略去),将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂(无水硫酸铜的乙醇饱和溶液)放入仪器B中,在仪器C中加入 12.2 g纯化后的苯甲酸晶体,30 mL无水乙醇(约0.5 mol)和3 mL浓硫酸,加入沸石,加热至微沸,回流反应1.5~2 h。仪器A的作用是_________;仪器C中反应液应采用_________方式加热。
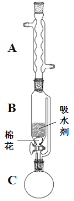
(3)随着反应进行,反应体系中水分不断被有效分离,仪器B中吸水剂的现象为_________。
(4)反应结束后,对C中混合液进行分离提纯,操作I是_________;操作II所用的玻璃仪器除了烧杯外还有_________。
(5)反应结束后,步骤③中将反应液倒入冷水的目的除了溶解乙醇外,还有_____;加入试剂X为_____(填写化学式)。
(6)最终得到产物纯品12.0 g,实验产率为_________ %(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,钠盐(Na2XO3)溶液中微粒浓度的变化关系如图所示[pOH=-lgc(OH-)]。下列说法正确的是

A.曲线N表示![]() 与pOH的变化关系
与pOH的变化关系
B.常温下,Ka2(H2XO3)=10-10
C.当pOH=2时, NaHXO3溶液中:![]()
D.向Na2XO3溶液中滴加稀盐酸至中性时,溶液中:c(Na+)=2c(HXO3-)+2c(XO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZrO2是重要的耐温材料,可用作陶瓷遮光剂。天然锆英石(ZrSiO4)含有铁、铝、铜等金属元素的氧化物杂质,工业以锆英石为原料制备ZrO2的工艺流程如下:

已知:Fe(SCN)3难溶于MIBK; Zr(SCN)4在水中溶解度不大,易溶于MIBK。
(1)锆英石中锆元素的化合价为____________。
(2)氯化主反应:ZrSiO4(s)+2C(s)+4Cl2(g) ![]() ZrCl4(g)+SiCl4(g)+2CO2(g) △H<0,ZrC14的产率随温度变化如图所示,由图可知氯化的最佳条件是_________。氯化过程ZrC14的产率随温度升高先增大后减小的原因是 __________。
ZrCl4(g)+SiCl4(g)+2CO2(g) △H<0,ZrC14的产率随温度变化如图所示,由图可知氯化的最佳条件是_________。氯化过程ZrC14的产率随温度升高先增大后减小的原因是 __________。

(3)写出A12O3高温氯化过程中转化为AlC13的化学方程式___________________;
(4)Na2S、H2S、NaCN等均为常用的铜沉淀剂,本流程使用NaCN除铜,不采用Na2S、H2S的原因是__________(用离子方程式解释)。若盐酸溶解后溶液中c(Cu2+)=0.01mol/L,当溶液中Cu2+开始沉淀时,c(CN-)= ___________。(已知Ksp[Cu(CN)2]=4.00×10-10)
(5)实验室进行萃取和反萃取的仪器是_______。流程中萃取与反萃取的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液分别加到HF溶液、CH3COOH溶液中,两混合溶液中离子浓度与pH的变化关系如图所示,已知pKa=-lgKa,下列有关叙述错误的是
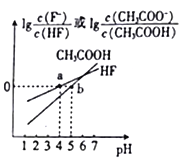
A. 常温下,Ka(CH3COOH)=10-5
B. a点时,c(F-)=c(HF)>c(Na+)>c(H+)>c(OH-)
C. 常温下,0.1mol/LNaF溶液的pH小于0.1mol/LCH3COONa溶液的pH
D. 向CH3COOH溶液中加入NaOH溶液后所得的混合溶液中, 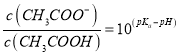
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是

A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
Ⅰ.一定条件下,A(g)+B(g) ![]() C(g) ΔH<0,达到平衡后根据下列图象判断:
C(g) ΔH<0,达到平衡后根据下列图象判断:
A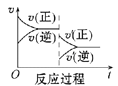 B
B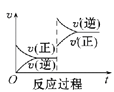 C
C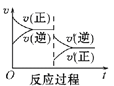 D
D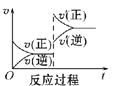
(1)升高温度,达到新平衡的是_____(选填字母),新平衡中C的体积分数______(选填“增大”“减小”或“不变”)。
(2)减小压强,达到新平衡的是________(选填字母),A的转化率________(选填“增大”“减小”或“不变”)。
Ⅱ. 取五等份NO2,分别充入五个温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g) ![]() N2O4(g) ΔH<0,反应一段时间后,分别测定体系中NO2的体积分数,并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是___。
N2O4(g) ΔH<0,反应一段时间后,分别测定体系中NO2的体积分数,并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是___。
①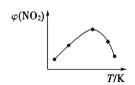 ②
②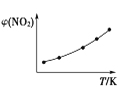 ③
③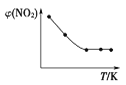 ④
④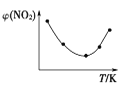
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①锌跟稀硫酸反应制H2,加入少量硫酸铜溶液能加快反应速率
②镀层破损后,白口铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀
③电镀时,应把镀件置于电解槽的阴极
④冶炼铝时,把氧化铝加入液态冰晶石中熔融后电解
⑤钢铁表面常易腐蚀生成Fe2O3·nH2O
A.全部B.①③④⑤C.①②⑤D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com