
【题目】ZrO2是重要的耐温材料,可用作陶瓷遮光剂。天然锆英石(ZrSiO4)含有铁、铝、铜等金属元素的氧化物杂质,工业以锆英石为原料制备ZrO2的工艺流程如下:

已知:Fe(SCN)3难溶于MIBK; Zr(SCN)4在水中溶解度不大,易溶于MIBK。
(1)锆英石中锆元素的化合价为____________。
(2)氯化主反应:ZrSiO4(s)+2C(s)+4Cl2(g) ![]() ZrCl4(g)+SiCl4(g)+2CO2(g) △H<0,ZrC14的产率随温度变化如图所示,由图可知氯化的最佳条件是_________。氯化过程ZrC14的产率随温度升高先增大后减小的原因是 __________。
ZrCl4(g)+SiCl4(g)+2CO2(g) △H<0,ZrC14的产率随温度变化如图所示,由图可知氯化的最佳条件是_________。氯化过程ZrC14的产率随温度升高先增大后减小的原因是 __________。

(3)写出A12O3高温氯化过程中转化为AlC13的化学方程式___________________;
(4)Na2S、H2S、NaCN等均为常用的铜沉淀剂,本流程使用NaCN除铜,不采用Na2S、H2S的原因是__________(用离子方程式解释)。若盐酸溶解后溶液中c(Cu2+)=0.01mol/L,当溶液中Cu2+开始沉淀时,c(CN-)= ___________。(已知Ksp[Cu(CN)2]=4.00×10-10)
(5)实验室进行萃取和反萃取的仪器是_______。流程中萃取与反萃取的目的是_________。
【答案】+4 360℃、1MPa 360℃以前反应未达到平衡,升温过程中反应继续向正向进行,产率不断增大;360℃以后反应达到平衡,由于该反应为放热反应,升温过程中平衡逆向移动,ZrCl4产率又减小 2Al2O3+3C+6Cl2![]() 4AlCl3+3CO2 2Fe3++H2S=2Fe2++S+2H+(2Fe3++S2-=2Fe2++S或2Fe3++3S2-=2FeS↓+S) 2×10-4mol/L 分液漏斗、烧杯 除去铁元素杂质
4AlCl3+3CO2 2Fe3++H2S=2Fe2++S+2H+(2Fe3++S2-=2Fe2++S或2Fe3++3S2-=2FeS↓+S) 2×10-4mol/L 分液漏斗、烧杯 除去铁元素杂质
【解析】
(1)根据化合物中元素正负化合价代数和等于0,结合Si、O元素化合价分析;
(2)制取ZrC14产率最大时为最合适的反应条件;根据温度对化学反应速率和化学平衡移动的影响分析判断;
(3) A12O3、焦炭在高温下与氯气反应产生AlCl3、CO2,根据电子守恒、原子守恒可得反应方程式;
(4)锆英石(ZrSiO4)含有铁元素的氧化物,在处理过程中有Fe3+,根据Fe3+与H2S或S2-发生的氧化还原反应分析判断;根据Ksp[Cu(CN)2]=c(Cu2+)·c2(CN-)=4.00×10-10计算判断;
(5)根据萃取是分离互不相溶的液体混合物的方法判断仪器的使用;根据Fe(SCN)3难溶于MIBK;Zr(SCN)4在水中溶解度不大,易溶于MIBK分析萃取的目的。
(1)由于在化合物中元素正负化合价代数和等于0,O为-2价,Si为+4价,可得锆英石(ZrSiO4)中Zr元素的化合价为+4价;
(2)根据图像可知在ZrC14的产率在温度为360℃、1MPa时最高,说明氯化的最佳条件是360℃、1MPa;
根据图象可知:在360℃以前,随着温度的升高,ZrC14的产率逐渐增大,是由于温度升高,反应物分子的能量增加,有效碰撞次数增加,反应速率加快,更多的反应物发生反应变为生成物,所以ZrC14的产率逐渐增大,到360℃达到最大值,此时反应达到平衡状态,由于该反应的正反应为放热反应,升高温度,化学平衡向吸热的逆反应方向移动,使ZrC14的产率逐渐降低,因此温度升高,ZrC14的产率又逐渐降低;
(3) A12O3、焦炭在高温下与氯气反应产生AlCl3、CO2,根据电子守恒、原子守恒可得该反应方程式为:2Al2O3+3C+6Cl2![]() 4AlCl3+3CO2;
4AlCl3+3CO2;
(4)在锆英石(ZrSiO4)含有铁元素的氧化物,在粉碎、氯化处理过程中有Fe3+生成,Fe3+具有氧化性,而H2S或S2-具有还原性,会发生氧化还原反应:2Fe3++H2S=2Fe2++S+2H+或2Fe3++S2-=2Fe2++S或2Fe3++3S2-=2FeS↓+S,影响Cu2+的沉淀,若用NaCN,就不会发生上述反应;由于Ksp[Cu(CN)2]=c(Cu2+)·c2(CN-)=4.00×10-10,c(Cu2+)=0.01mol/L,当溶液中Cu2+开始沉淀时,c(CN-)=![]() =2.00×10-4mol/L;
=2.00×10-4mol/L;
(5)由于萃取是分离互不相溶的液体混合物的方法,所以萃取和反萃取使用的仪器有分液漏斗和烧杯;在处理过程中Cu2+与沉淀试剂形成Cu(CN)2沉淀过滤除去,Fe3+与加入的NH4SCN形成络合物Fe(SCN)3,Zr4+形成Zr(SCN)4,由于Fe(SCN)3难溶于MIBK,而Zr(SCN)4在水中溶解度不大,易溶于MIBK,向Fe(SCN)3、Zr(SCN)4的混合溶液中加入MIBK充分振荡后,分液,可将Fe(SCN)3分离除去,然后向MIBK的溶液中加入硫酸进行反萃取,Zr(SCN)4进入硫酸溶液中,然后经过一系列处理,就可得到ZrO2。所以进行萃取和反萃取目的是除去铁元素杂质。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为___,原子个数比为___。
(2)同温同压下,等体积的O2和O3质量比为___。
(3)配制100mL1mol·L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g·mL-1,质量分数为98%)的体积为___mL。
(4)现要配制1mol·L-1Na2CO3溶液250mL,需要含结晶水的碳酸钠晶体(Na2CO3·10H2O)___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)AlCl3溶液呈________性(填“酸”“中”或“碱”),原因是____________________________(用离子方程式表示)。把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是____________________(写化学式)。实验室在保存AlCl3溶液时,常在溶液中加少量的________,以抑制其水解。
(2)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈________性(填“酸”“中”或“碱”),溶液中[Na+]________[CH3COO-](填“>”“=”或“<”)。
(3)25 ℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈________性(填“酸”“中”或“碱”),溶液中,[Na+]________[CH3COO-](填“>”“=”或“<”)。
(4)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈________性(填“酸”“中”或“碱”),醋酸体积________氢氧化钠溶液体积(填“>”“=”或“<”)。
(5)已知0.1 mol·L-1的NaHCO3溶液pH=9,则溶液中[CO32-]________[H2CO3](填“>”“=”或“<”),其溶液显电中性的原因是________________________(用离子浓度关系式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1 mol·Lˉ1的NaOH溶液和氨水,下列说法正确的是
A. c(NH3H2O) + c(NH4+) = c(Na+)
B. NH3的水溶液能导电,所以NH3是电解质
C. 氨水的pH大于NaOH溶液
D. 将浓度为0.1 mol·Lˉ1的盐酸和氨水等体积混合后,所得溶液中:c(OH-) > c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示示意图,下列说法不正确的是

A. 反应的热化学方程式可表示为C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B. 该反应过程反应物断键吸收的能量大于生成物成键放出的能量
C. a mol C和a mol H2O反应生成a mol CO和a mol H2吸收的热量一定为131.3a kJ
D. 1 mol C(g)、2 mol H、1 mol O转变成1 mol CO(g)和1 mol H2(g)放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了科学饮食,了解一些与食品相关的化学知识是必要的。
(1)油炸虾条、薯片等容易挤碎的食品,不宜选用真空袋装,而应采用充气袋装。下列气体中不应该充入的是________(填序号,下同)。
A.氮气 B.二氧化碳
C.空气 D.氧气
(2)为使以面粉为原料的面包松软可口,通常用碳酸氢钠作发泡剂,因为它________。
A.热稳定性差 B.增加甜味
C.产生二氧化碳 D.提供钠离子
(3)能直接鉴别氯化钠和葡萄糖两种未知浓度溶液的方法是________。
A.观察颜色 B.测量比值
C.加热灼烧 D.分别闻味
(4)苯甲酸钠是常用的食品防腐剂,其结构简式如图。以下对苯甲酸钠描述错误的是________。

A.属于盐类 B.能溶于水
C.属于烃类 D.不易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁![]() 是一种补铁强化剂广泛用于缺铁性贫血的预防和治疗。某学习小组欲利用硫酸亚铁溶液与甘氨酸反应制备甘氨酸亚铁,有关物质性质如表:
是一种补铁强化剂广泛用于缺铁性贫血的预防和治疗。某学习小组欲利用硫酸亚铁溶液与甘氨酸反应制备甘氨酸亚铁,有关物质性质如表:
甘氨酸( | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程
实验1制备![]() :将含
:将含![]() 的溶液与
的溶液与![]() 溶液混合,反应结束后过滤并洗涤沉淀。
溶液混合,反应结束后过滤并洗涤沉淀。
实验2制备![]() :
:
实验装置如图(夹持和加热仪器已省略),将实验1得到的沉淀和含![]() 甘氨酸的水溶液混合后加入
甘氨酸的水溶液混合后加入![]() 中。利用
中。利用![]() 中的反应将
中的反应将![]() 中空气排净,接着滴入柠檬酸溶液并加热。
中空气排净,接着滴入柠檬酸溶液并加热。
实验3提纯![]() :反应结束后过,将滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品。
:反应结束后过,将滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品。
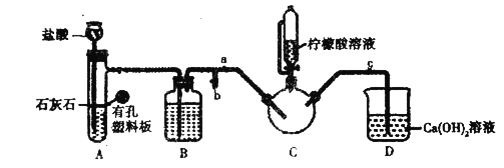
(1)写出实验1中制备![]() 的离子方程式_________________。
的离子方程式_________________。
(2)装盐酸的仪器名称是__________,装置![]() 中的试剂是__________。
中的试剂是__________。
(3)实验2中,打开![]() 关闭
关闭![]() ,排尽空气。确认
,排尽空气。确认![]() 中空气排尽的实验现象是________________,排尽空气后进行的实验操作是________,接着滴入柠檬酸溶液并加热。
中空气排尽的实验现象是________________,排尽空气后进行的实验操作是________,接着滴入柠檬酸溶液并加热。
(4)实验2中的柠酸可调节溶液![]() ,体系
,体系![]() 与产率的关系如表
与产率的关系如表
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
体系 | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 |
产率(%) | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 |
![]() 过低产率下降的原因是________________________;柠檬酸的作用还有_______。
过低产率下降的原因是________________________;柠檬酸的作用还有_______。
(5)实验3中加入乙醇的目的是____________________。
(6)若产品的质量为![]() ,则产率为__________________%。
,则产率为__________________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A. 表示硫的燃烧热的热化学方程式S(s)+![]() O2(g)=SO3(g);ΔH=-315 kJ·mol-1
O2(g)=SO3(g);ΔH=-315 kJ·mol-1
B. 表示中和热的热化学方程式NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-57.3 kJ·mol-1
C. 表示H2燃烧热的热化学方程式H2(g)+![]() O2(g)=H2O(g);ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g);ΔH=-241.8 kJ·mol-1
D. 表示CO燃烧热的热化学方程式2CO(g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物M的合成路线如下:

已知:![]()
(1)A中含氧官能团的名称是______。
(2)反应①的试剂和条件为_______,B的结构简式为______。
(3)D为酯类,以乙醛为原料,写出合成D所涉及的化学方程式______。
(4)2 D → E + C2H5OH,F中含有醇羟基,写出下列物质的结构简式:E________ F________G___
(5)反应①~⑥中属于取代反应的有______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com