
ΓΨΧβΡΩΓΩΗ Α±Υα―«Χζ![]() «“Μ÷÷≤ΙΧζ«ΩΜ·ΦΝΙψΖΚ”Ο”Ύ»±Χζ–‘ΤΕ―ΣΒΡ‘ΛΖάΚΆ÷ΈΝΤΓΘΡ≥―ßœΑ–ΓΉι”ϊάϊ”ΟΝρΥα―«Χζ»ή“Κ”κΗ Α±ΥαΖ¥”Π÷Τ±ΗΗ Α±Υα―«ΧζΘ§”–ΙΊΈο÷ –‘÷ »γ±μΘΚ
«“Μ÷÷≤ΙΧζ«ΩΜ·ΦΝΙψΖΚ”Ο”Ύ»±Χζ–‘ΤΕ―ΣΒΡ‘ΛΖάΚΆ÷ΈΝΤΓΘΡ≥―ßœΑ–ΓΉι”ϊάϊ”ΟΝρΥα―«Χζ»ή“Κ”κΗ Α±ΥαΖ¥”Π÷Τ±ΗΗ Α±Υα―«ΧζΘ§”–ΙΊΈο÷ –‘÷ »γ±μΘΚ
Η Α±Υα( | ΡϊΟ Υα | Η Α±Υα―«Χζ |
“Ή»ή”ΎΥ°Θ§ΈΔ»ή”Ύ““¥ΦΘ§ΝΫ–‘Μ·ΚœΈο | “Ή»ή”ΎΥ°ΚΆ““¥ΦΘ§”–«ΩΥα–‘ΚΆΜΙ‘≠–‘ | “Ή»ή”ΎΥ°Θ§Ρ―»ή”Ύ““¥Φ |
Β―ιΙΐ≥Χ
Β―ι1÷Τ±Η![]() ΘΚΫΪΚ§
ΘΚΫΪΚ§![]() ΒΡ»ή“Κ”κ
ΒΡ»ή“Κ”κ![]() »ή“ΚΜλΚœΘ§Ζ¥”ΠΫα χΚσΙΐ¬Υ≤Δœ¥Β”≥ΝΒμΓΘ
»ή“ΚΜλΚœΘ§Ζ¥”ΠΫα χΚσΙΐ¬Υ≤Δœ¥Β”≥ΝΒμΓΘ
Β―ι2÷Τ±Η![]() ΘΚ
ΘΚ
Β―ιΉΑ÷Ο»γΆΦ(Φ–≥÷ΚΆΦ”»»“«Τς“― Γ¬‘)Θ§ΫΪ Β―ι1ΒΟΒΫΒΡ≥ΝΒμΚΆΚ§![]() Η Α±ΥαΒΡΥ°»ή“ΚΜλΚœΚσΦ”»κ
Η Α±ΥαΒΡΥ°»ή“ΚΜλΚœΚσΦ”»κ![]() ÷–ΓΘάϊ”Ο
÷–ΓΘάϊ”Ο![]() ÷–ΒΡΖ¥”ΠΫΪ
÷–ΒΡΖ¥”ΠΫΪ![]() ÷–Ω’Τχ≈≈ΨΜΘ§Ϋ”Ή≈ΒΈ»κΡϊΟ Υα»ή“Κ≤ΔΦ”»»ΓΘ
÷–Ω’Τχ≈≈ΨΜΘ§Ϋ”Ή≈ΒΈ»κΡϊΟ Υα»ή“Κ≤ΔΦ”»»ΓΘ
Β―ι3Χα¥Ω![]() ΘΚΖ¥”ΠΫα χΚσΙΐΘ§ΫΪ¬Υ“Κ’τΖΔ≈®ΥθΘ§Φ”»κ““¥ΦΘ§Ιΐ¬ΥΓΔΗ…‘οΒΟΒΫ≤ζΤΖΓΘ
ΘΚΖ¥”ΠΫα χΚσΙΐΘ§ΫΪ¬Υ“Κ’τΖΔ≈®ΥθΘ§Φ”»κ““¥ΦΘ§Ιΐ¬ΥΓΔΗ…‘οΒΟΒΫ≤ζΤΖΓΘ
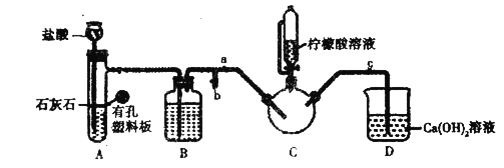
(1)–¥≥ω Β―ι1÷–÷Τ±Η![]() ΒΡάκΉ”ΖΫ≥Χ Ϋ_________________ΓΘ
ΒΡάκΉ”ΖΫ≥Χ Ϋ_________________ΓΘ
(2)ΉΑ―ΈΥαΒΡ“«ΤςΟϊ≥Τ «__________Θ§ΉΑ÷Ο![]() ÷–ΒΡ ‘ΦΝ «__________ΓΘ
÷–ΒΡ ‘ΦΝ «__________ΓΘ
(3) Β―ι2÷–Θ§¥ρΩΣ![]() ΙΊ±’
ΙΊ±’![]() Θ§≈≈ΨΓΩ’ΤχΓΘ»Ζ»œ
Θ§≈≈ΨΓΩ’ΤχΓΘ»Ζ»œ![]() ÷–Ω’Τχ≈≈ΨΓΒΡ Β―ιœ÷œσ «________________Θ§≈≈ΨΓΩ’ΤχΚσΫχ––ΒΡ Β―ι≤ΌΉς «________Θ§Ϋ”Ή≈ΒΈ»κΡϊΟ Υα»ή“Κ≤ΔΦ”»»ΓΘ
÷–Ω’Τχ≈≈ΨΓΒΡ Β―ιœ÷œσ «________________Θ§≈≈ΨΓΩ’ΤχΚσΫχ––ΒΡ Β―ι≤ΌΉς «________Θ§Ϋ”Ή≈ΒΈ»κΡϊΟ Υα»ή“Κ≤ΔΦ”»»ΓΘ
(4) Β―ι2÷–ΒΡΡϊΥαΩ…ΒςΫΎ»ή“Κ![]() Θ§ΧεœΒ
Θ§ΧεœΒ![]() ”κ≤ζ¬ ΒΡΙΊœΒ»γ±μ
”κ≤ζ¬ ΒΡΙΊœΒ»γ±μ
Β―ι | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
ΧεœΒ | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 |
≤ζ¬ (%) | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 |
![]() ΙΐΒΆ≤ζ¬ œ¬ΫΒΒΡ‘≠“ρ «________________________ΘΜΡϊΟ ΥαΒΡΉς”ΟΜΙ”–_______ΓΘ
ΙΐΒΆ≤ζ¬ œ¬ΫΒΒΡ‘≠“ρ «________________________ΘΜΡϊΟ ΥαΒΡΉς”ΟΜΙ”–_______ΓΘ
(5) Β―ι3÷–Φ”»κ““¥ΦΒΡΡΩΒΡ «____________________ΓΘ
(6)»τ≤ζΤΖΒΡ÷ ΝΩΈΣ![]() Θ§‘ρ≤ζ¬ ΈΣ__________________%ΓΘ
Θ§‘ρ≤ζ¬ ΈΣ__________________%ΓΘ
ΓΨ¥πΑΗΓΩ![]() ≥ΛΨ±¬©ΕΖ ±ΞΚΆΧΦΥα«βΡΤ»ή“Κ
≥ΛΨ±¬©ΕΖ ±ΞΚΆΧΦΥα«βΡΤ»ή“Κ ![]() ÷–≥Έ«ε ·Μ“Υ°±δΜκΉ« ¥ρΩΣ
÷–≥Έ«ε ·Μ“Υ°±δΜκΉ« ¥ρΩΣ![]() ΙΊ±’
ΙΊ±’![]()
![]() ΙΐΒΆΘ§«βάκΉ”Μα”κΗ Α±Υα÷–ΒΡΑ±ΜυΖ¥”Π Ζά÷Ι―«ΧζάκΉ”±Μ―θΜ· Φθ…ΌΗ Α±Υα―«ΧζΒΡ»ήΫβΝΩΘ§¥Ό ΙΤδΫαΨßΈω≥ω 80.00
ΙΐΒΆΘ§«βάκΉ”Μα”κΗ Α±Υα÷–ΒΡΑ±ΜυΖ¥”Π Ζά÷Ι―«ΧζάκΉ”±Μ―θΜ· Φθ…ΌΗ Α±Υα―«ΧζΒΡ»ήΫβΝΩΘ§¥Ό ΙΤδΫαΨßΈω≥ω 80.00
ΓΨΫβΈωΓΩ
FeSO4»ή“Κ”κNH4HCO3»ή“ΚΖ¥”Π÷Τ±ΗFeCO3≥ΝΒμΘ§ΫΪFeCO3”κΚΆΚ§0.20molΗ Α±ΥαΒΡΥ°»ή“ΚΜλΚœΚσΦ”»κC÷–Θ§»ΜΚσάϊ”ΟA÷–ΒΡΖ¥”ΠΫΪC÷–Ω’Τχ≈≈ΨΓΘ§Ϋ”Ή≈ΒΈ»κΡϊΟ Υα»ή“Κ≤ΔΦ”»»Θ§Ζ¥”ΠΫα χΚσΙΐ¬ΥΘ§¬Υ“ΚΨ≠’τΖΔΫαΨßΓΔΙΐ¬ΥΓΔœ¥Β”ΓΔΗ…‘οΚσΒΟΒΫ≤ζΤΖΘ§
Θ®1Θ©ΕΰΦέΧζάκΉ””κΧΦΥα«βΗυάκΉ”Ζ¥”Π…ζ≥…ΧΦΥαΧζ≥ΝΒμΘΜ
Θ®2Θ©ΗυΨί“«ΤςΫαΙΙ”κΧΊ’ςΫβ¥πΘΜΉΑ÷ΟB ‘ΦΝΒΡΡΩΒΡ «≥ΐ»ΞΕΰ―θΜ·ΧΦ÷–ΒΡ¬»Μ·«βΘΜ
Θ®3Θ©ΗυΨί Β―ιΜυ±Ψ≤ΌΉςΦΑœ÷œσΖ÷ΈωΘΜ
Θ®4Θ©NH2CH2COOH÷–ΒΡΑ±ΜυΩ…“‘”κ«βάκΉ”ΫαΚœΘ§Ψί¥ΥΖ÷ΈωΘΜΡϊΟ Υα”–«ΩΥα–‘ΚΆΜΙ‘≠–‘ΘΜ
Θ®5Θ©ΗυΨίΗ Α±Υα―«Χζ“Ή»ή”ΎΥ°Θ§Ρ―»ή”Ύ““¥ΦΖ÷ΈωΘΜ
Θ®6Θ©ΗυΨίΧβ“βΘ§FeCO3ΙΐΝΩΘ§0.20molΗ Α±ΥαΖ¥”ΠΆξ»ΪΘ§ΗυΨί÷ ΝΩ ΊΚψ”–ΙΊœΒ ΫΘΚ2NH2CH2COOHΓΪΘ®NH3CH3COOΘ©2FeΘ§‘ράμ¬έ…œΒΟΒΫΒΡΘ®NH3CH3COOΘ©2FeΒΡΈο÷ ΒΡΝΩΈΣ![]() nΘ®NH2CH2COOHΘ©=0.10molΘ§÷ ΝΩΈΣ0.01molΓΝ204g/mol=20.4gΘ§Ψί¥ΥΦΤΥψΓΘ
nΘ®NH2CH2COOHΘ©=0.10molΘ§÷ ΝΩΈΣ0.01molΓΝ204g/mol=20.4gΘ§Ψί¥ΥΦΤΥψΓΘ
Θ®1Θ©Fe2ΘΪΚΆHCO3Θ≠ΖΔ…ζΖ¥”Π…ζ≥…FeCO3≥ΝΒμΓΔCO2ΚΆH2OΘ§άκΉ”ΖΫ≥Χ ΫΈΣΘΚFe2++2HCO3Θ≠=FeCO3Γΐ+CO2Γϋ+ H2OΘ§Ι ¥πΑΗΈΣΘΚFe2++2HCO3Θ≠=FeCO3Γΐ+CO2Γϋ+ H2OΘΜ
Θ®2Θ©ΉΑ―ΈΥαΒΡ“«ΤςΈΣ≥ΛΨ±¬©ΕΖΘ§ ‘ΦΝB÷ς“Σ «ΈΣΝΥ≥ΐ»ΞΕΰ―θΜ·ΧΦ÷–ΒΡ¬»Μ·«βΘ§‘ρΈΣ±ΞΚΆΧΦΥα«βΡΤ»ή“ΚΘ§Ι ¥πΑΗΈΣΘΚ≥ΛΨ±¬©ΕΖΘΜ±ΞΚΆΧΦΥα«βΡΤ»ή“ΚΘΜ
Θ®3Θ©Β±C÷–≥δ¬ζCO2ΚσΘ§CO2ΩΣ ΦΫχ»κD÷–Θ§ ΙD÷–ΒΡ≥Έ«ε ·Μ“Υ°±δΜκΉ«Θ§’β ±ΥΒΟςC÷–Ω’Τχ“―Ψ≠≈≈ΨΓΘ§Ι ¥πΑΗΈΣΘΚD÷–≥Έ«ε ·Μ“Υ°±δΜκΉ«ΘΜάϊ”ΟA÷–ΒΡΖ¥”ΠΫΪC÷–Ω’Τχ≈≈ΨΓΚσΘ§¥ρΩΣ![]() ΙΊ±’
ΙΊ±’![]() Ϋ”Ή≈ΒΈ»κΡϊΟ Υα»ή“Κ≤ΔΦ”»»Θ§Ι ¥πΑΗΈΣΘΚ
Ϋ”Ή≈ΒΈ»κΡϊΟ Υα»ή“Κ≤ΔΦ”»»Θ§Ι ¥πΑΗΈΣΘΚ![]() ÷–≥Έ«ε ·Μ“Υ°±δΜκΉ«ΘΜ¥ρΩΣ
÷–≥Έ«ε ·Μ“Υ°±δΜκΉ«ΘΜ¥ρΩΣ![]() ΙΊ±’
ΙΊ±’![]() ΘΜ
ΘΜ
Θ®4Θ©NH2CH2COOH÷–ΒΡΑ±Μυœ‘Φν–‘Θ§pHΙΐΒΆ Ι≤ζ¬ œ¬ΫΒΒΡ‘≠“ρ «H+Μα”κNH2CH2COOHΖ¥”ΠΘΜΗυΨί–≈œΔΘ§ΡϊΟ ΥαΨΏ”–ΜΙ‘≠–‘ΚΆ«ΩΥα–‘Θ§ΡήΙΜ¥ΌΫχFeCO3ΒΡ»ήΫβΘ§Ζά÷ΙFe2ΘΪ±Μ―θΜ·ΘΜ
Ι ¥πΑΗΈΣΘΚ![]() ΙΐΒΆΘ§«βάκΉ”Μα”κΗ Α±Υα÷–ΒΡΑ±ΜυΖ¥”ΠΘΜΖά÷Ι―«ΧζάκΉ”±Μ―θΜ·
ΙΐΒΆΘ§«βάκΉ”Μα”κΗ Α±Υα÷–ΒΡΑ±ΜυΖ¥”ΠΘΜΖά÷Ι―«ΧζάκΉ”±Μ―θΜ·
Θ®5Θ©”…”ΎΗ Α±Υα―«Χζ“Ή»ή”ΎΥ°Θ§Ρ―»ή”Ύ““¥ΦΘ§Ι ΈΣΫΒΒΆΗ Α±Υα―«ΧζΒΡ»ήΫβΕ»Θ§ΧαΗΏ≤ζ¬ ΚΆ¥ΩΕ»Θ§”Ο““¥Φœ¥Β”Θ§Ι ¥πΑΗΈΣΘΚΦθ…ΌΗ Α±Υα―«ΧζΒΡ»ήΫβΝΩΘ§¥Ό ΙΤδΫαΨßΈω≥ωΘΜ
Θ®6Θ©ΗυΨίΧβ“βΘ§FeCO3ΙΐΝΩΘ§0.20 molΗ Α±ΥαΖ¥”ΠΆξ»Ϊ,ΗυΨί÷ ΝΩ ΊΚψ”–ΙΊœΒ ΫΘΚ2NH2CH2COOH(NH3CH3COO)2FeΘ§
‘ράμ¬έ…œΒΟΒΫΒΡ(NH3CH3COO)2FeΒΡΈο÷ ΒΡΝΩΈΣ12n(NH2CH2COOH)=0.10
‘ρ≤ζ¬ ΈΣΘΚ![]() =80.00%Θ§Ι ¥πΑΗΈΣΘΚ80.00%ΓΘ
=80.00%Θ§Ι ¥πΑΗΈΣΘΚ80.00%ΓΘ


 Οϊ–ΘΩΈΧΟœΒΝ–¥πΑΗ
Οϊ–ΘΩΈΧΟœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ÷”–mgΡ≥ΤχΧεΘ§Υϋ”…ΥΪ‘≠Ή”Ζ÷Ή”ΙΙ≥…Θ§ΥϋΒΡΡΠΕϊ÷ ΝΩΈΣMg/molΓΘ»τΑΔΖϋΦ”Β¬¬ό≥Θ ΐ”ΟNA±μ ΨΘ§‘ρΘΚ
Θ®1Θ©ΗΟΤχΧεΒΡΈο÷ ΒΡΝΩΈΣ________molΘΜ
Θ®2Θ©ΗΟΤχΧεΥυΚ§‘≠Ή”Ήή ΐΈΣ_________ΗωΘΜ
Θ®3Θ©ΗΟΤχΧε‘Ύ±ξΉΦΉ¥Ωωœ¬ΒΡΧεΜΐΈΣ_________LΘΜ
Θ®4Θ©ΗΟΤχΧε»ή”ΎΥ°Κσ–Έ≥…VL»ή“ΚΘ§Τδ»ή“ΚΒΡΈο÷ ΒΡΝΩ≈®Ε»ΈΣ_________mol/LΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩο·(![]() ) «œ÷¥ζΙΛ“ΒΒΡ÷Ί“ΣΫπ τ‘≠ΝœΘ§ΨΏ”–ΝΦΚΟΒΡΩ…Υή–‘Θ§ΩΙ ¥–‘Ρή≥§Ιΐν―ΓΘ“‘ο·”Δ ·(÷ς“Σ≥…Ζ÷ «
) «œ÷¥ζΙΛ“ΒΒΡ÷Ί“ΣΫπ τ‘≠ΝœΘ§ΨΏ”–ΝΦΚΟΒΡΩ…Υή–‘Θ§ΩΙ ¥–‘Ρή≥§Ιΐν―ΓΘ“‘ο·”Δ ·(÷ς“Σ≥…Ζ÷ «![]() Θ§ΜΙΚ§”–…ΌΝΩ
Θ§ΜΙΚ§”–…ΌΝΩ![]() Β»‘”÷ )ΈΣ‘≠Νœ…ζ≤ζο·ΦΑΤδΜ·ΚœΈοΒΡΝς≥Χ»γΆΦΥυ Ψ
Β»‘”÷ )ΈΣ‘≠Νœ…ζ≤ζο·ΦΑΤδΜ·ΚœΈοΒΡΝς≥Χ»γΆΦΥυ Ψ

(1)–¥≥ω![]() ΒΡΒγΉ” Ϋ____________________ΓΘ
ΒΡΒγΉ” Ϋ____________________ΓΘ
(2)ΗΏΈ¬ΤχΜ·Ιΐ≥Χ÷–Θ§≤ΜΩΦ¬«Υπ ßΘ§ΖΔœ÷Ζ÷ΝσΚσΒΟΒΫΒΡ![]() ÷ ΝΩΆ®≥Θ±»”…¥Ω
÷ ΝΩΆ®≥Θ±»”…¥Ω![]() ΖΔ…ζΒΡΖ¥”ΠΒΟΒΫΒΡ
ΖΔ…ζΒΡΖ¥”ΠΒΟΒΫΒΡ![]() ÷ ΝΩ¥σΘ§”ΟΜ·―ßΖΫ≥Χ Ϋά¥Ϋβ Ά‘≠“ρ_________________________ΓΘ
÷ ΝΩ¥σΘ§”ΟΜ·―ßΖΫ≥Χ Ϋά¥Ϋβ Ά‘≠“ρ_________________________ΓΘ
(3)ΗΏΈ¬ΤχΜ·ΚσΒΡΙΧΧε≤–‘ϋ≥ΐΧΦΆβΘ§ΜΙ”–![]() ΚΆ
ΚΆ![]() Θ§Φ”Υ°Ϋΰ»ΓΒΟ¬»Μ·Χζ»ή“ΚΘ§Ιΐ¬ΥΘ§¥”¬Υ‘ϋ÷–Ζ÷άκ≥ωΧΦΚΆ
Θ§Φ”Υ°Ϋΰ»ΓΒΟ¬»Μ·Χζ»ή“ΚΘ§Ιΐ¬ΥΘ§¥”¬Υ‘ϋ÷–Ζ÷άκ≥ωΧΦΚΆ![]() ΝΫ÷÷ΙΧΧεΒΡΖΫΖ® «____________________ΓΘ
ΝΫ÷÷ΙΧΧεΒΡΖΫΖ® «____________________ΓΘ
(4)–¥≥ω…œ ωΝς≥Χ÷–![]() ”κΥ°Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΘΚ____________________________ΓΘ
”κΥ°Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΘΚ____________________________ΓΘ
(5)“―÷Σ―θΜ·ο·(![]() ) «“Μ÷÷ΝΫ–‘―θΜ·ΈοΘ§”κ«β―θΜ·ΡΤΙ≤»έ»ΎΩ…–Έ≥…Υα―ΈΘ§«κ–¥≥ωΜ·―ßΖΫ≥Χ Ϋ_________________________________________ΓΘ
) «“Μ÷÷ΝΫ–‘―θΜ·ΈοΘ§”κ«β―θΜ·ΡΤΙ≤»έ»ΎΩ…–Έ≥…Υα―ΈΘ§«κ–¥≥ωΜ·―ßΖΫ≥Χ Ϋ_________________________________________ΓΘ
(6)ΙΛ“Β…œΩ…”ΟΦΊΜΙ‘≠![]() ±÷ΤΒΟΫπ τ
±÷ΤΒΟΫπ τ![]() Θ§
Θ§![]() ±ΜΜΙ‘≠ ±…ζ≥…ΒΡΦΊ―ΈΒΡΈο÷ ΒΡΝΩΈΣ_________________ΓΘ
±ΜΜΙ‘≠ ±…ζ≥…ΒΡΦΊ―ΈΒΡΈο÷ ΒΡΝΩΈΣ_________________ΓΘ
(7)“―÷Σ![]() Θ§
Θ§![]() ΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «__________
ΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «__________
AΘ°![]() Θ§ΒγΫβ÷ »ή“ΚΒΡ
Θ§ΒγΫβ÷ »ή“ΚΒΡ![]() ”κ
”κ![]() ÷°ΚΆΨυΈΣ14
÷°ΚΆΨυΈΣ14
BΘ°”Ο―ΈΥαΒΈΕ®Ρ≥≈®Ε»ΒΡ![]() »ή“ΚΘ§ΒΈΕ®Ιΐ≥Χ÷–
»ή“ΚΘ§ΒΈΕ®Ιΐ≥Χ÷–![]() ÷πΫΞ‘ω¥σ
÷πΫΞ‘ω¥σ
CΘ°![]() »ή“Κ÷–÷πΒΈΦ”»κΝρΥα»ή“ΚΘ§ΒΈΦ”Ιΐ≥Χ÷–
»ή“Κ÷–÷πΒΈΦ”»κΝρΥα»ή“ΚΘ§ΒΈΦ”Ιΐ≥Χ÷–![]() ÷πΫΞΦθ–Γ
÷πΫΞΦθ–Γ
DΘ°Ρ≥Έ¬Ε»œ¬![]() Θ§‘ρΤδ»ή“Κ÷–
Θ§‘ρΤδ»ή“Κ÷–![]()
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩZrO2 «÷Ί“ΣΒΡΡΆΈ¬≤ΡΝœΘ§Ω…”ΟΉςΧ’¥…’ΎΙβΦΝΓΘΧλ»Μο·”Δ ·(ZrSiO4)Κ§”–ΧζΓΔ¬ΝΓΔΆ≠Β»Ϋπ τ‘ΣΥΊΒΡ―θΜ·Έο‘”÷ Θ§ΙΛ“Β“‘ο·”Δ ·ΈΣ‘≠Νœ÷Τ±ΗZrO2ΒΡΙΛ“’Νς≥Χ»γœ¬ΘΚ

“―÷ΣΘΚFe(SCN)3Ρ―»ή”ΎMIBKΘΜ Zr(SCN)4‘ΎΥ°÷–»ήΫβΕ»≤Μ¥σΘ§“Ή»ή”ΎMIBKΓΘ
(1)ο·”Δ ·÷–ο·‘ΣΥΊΒΡΜ·ΚœΦέΈΣ____________ΓΘ
(2)¬»Μ·÷ςΖ¥”ΠΘΚZrSiO4(s)+2C(s)+4Cl2(g) ![]() ZrCl4(g)+SiCl4(g)+2CO2(g) ΓςH<0Θ§ZrC14ΒΡ≤ζ¬ ΥφΈ¬Ε»±δΜ·»γΆΦΥυ ΨΘ§”…ΆΦΩ…÷Σ¬»Μ·ΒΡΉνΦ―ΧθΦΰ «_________ΓΘ¬»Μ·Ιΐ≥ΧZrC14ΒΡ≤ζ¬ ΥφΈ¬Ε»…ΐΗΏœ»‘ω¥σΚσΦθ–ΓΒΡ‘≠“ρ « __________ΓΘ
ZrCl4(g)+SiCl4(g)+2CO2(g) ΓςH<0Θ§ZrC14ΒΡ≤ζ¬ ΥφΈ¬Ε»±δΜ·»γΆΦΥυ ΨΘ§”…ΆΦΩ…÷Σ¬»Μ·ΒΡΉνΦ―ΧθΦΰ «_________ΓΘ¬»Μ·Ιΐ≥ΧZrC14ΒΡ≤ζ¬ ΥφΈ¬Ε»…ΐΗΏœ»‘ω¥σΚσΦθ–ΓΒΡ‘≠“ρ « __________ΓΘ

(3)–¥≥ωA12O3ΗΏΈ¬¬»Μ·Ιΐ≥Χ÷–ΉΣΜ·ΈΣAlC13ΒΡΜ·―ßΖΫ≥Χ Ϋ___________________ΘΜ
(4)Na2SΓΔH2SΓΔNaCNΒ»ΨυΈΣ≥Θ”ΟΒΡΆ≠≥ΝΒμΦΝΘ§±ΨΝς≥Χ Ι”ΟNaCN≥ΐΆ≠Θ§≤Μ≤…”ΟNa2SΓΔH2SΒΡ‘≠“ρ «__________Θ®”ΟάκΉ”ΖΫ≥Χ ΫΫβ ΆΘ©ΓΘ»τ―ΈΥα»ήΫβΚσ»ή“Κ÷–c(Cu2+)=0.01mol/LΘ§Β±»ή“Κ÷–Cu2+ΩΣ Φ≥ΝΒμ ±Θ§c(CN-)= ___________ΓΘ(“―÷ΣKsp[Cu(CN)2]=4.00ΓΝ10-10)
(5) Β―ι “Ϋχ––ίΆ»ΓΚΆΖ¥ίΆ»ΓΒΡ“«Τς «_______ΓΘΝς≥Χ÷–ίΆ»Γ”κΖ¥ίΆ»ΓΒΡΡΩΒΡ «_________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ«Π–νΒγ≥ΊΒΡ Ψ“βΆΦ»γΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «

A. Ζ≈Βγ ±Θ§NΈΣΗΚΦΪΘ§ΤδΒγΦΪΖ¥”Π ΫΘΚPbO2+SO42-+4H++2e-=PbSO4+2H2O
B. Ζ≈Βγ ±Θ§c(H2 SO4)≤Μ±δΘ§ΝΫΦΪΒΡ÷ ΝΩ‘ωΦ”
C. Ζ≈Βγ ±Θ§SO42-œρM.NΝΫΗωΒγΦΪ“ΤΕ·
D. Ζ≈Βγ ±Θ§’ΐΦΪΖ¥”Π ΫΘΚPbSO4+2e-=Pb+SO42-
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–άκΉ”ΖΫ≥Χ Ϋ÷–Θ§ ι–¥¥μΈσΒΡ «(ΓΓΓΓ)
A.ΧΦΥαΡΤ»ή“ΚΗζœΓΝρΥαΜλΚœΘΚ CO32©¹+2H+=H2O+CO2Γϋ
B.œθΥαΆ≠»ή“Κ÷–ΒΈΦ”…’Φν»ή“ΚΘΚ Cu2++2OHΘ≠=Cu(OH)2Γΐ
C.ΫΪCO2Ά®»κΉψΝΩΒΡ«β―θΜ·ΡΤ»ή“Κ÷–ΘΚ 2OHΘ≠+CO2=CO32©¹+H2O
D.ΝρΥα»ή“Κ÷–Φ”»κBa(OH)2»ή“ΚΘΚ Ba2++ SO![]() Θ≠=BaSO4Γΐ
Θ≠=BaSO4Γΐ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΧΦΉε‘ΣΥΊ(Carbon group)Αϋά®ΧΦ(C)ΓΔΙη(Si)ΓΔ’ύ(Ge)ΓΔΈΐ(Sn)ΓΔ«Π(Pb)ΓΔβa(Fl)Νυ÷÷ΓΘ
(1)“―÷ΣSnΈΣ50Κ≈‘ΣΥΊΘ§ΤδΦέΒγΉ”≈≈≤Φ ΫΈΣ ______ΘΜΦέΒγΉ”÷–≥…Ε‘ΒγΉ” ΐΈΣ______ΗωΓΘ
(2)“―÷ΣCO”κN2ΒΡΫαΙΙœύΥΤΘ§‘ρCOΒΡΒγΉ” ΫΈΣ______Θ§CΓΔOΓΔNΒΎ“ΜΒγάκΡή”…¥σΒΫ–ΓΒΡΥ≥–ρΈΣ______Θ§»ΐ’ΏΉνΦρΒΞ«βΜ·ΈοΒΡ»έΖ–ΒψΗΏΒΆΥ≥–ρΈΣ ______(”ΟΓΑΜ·―ß ΫΓ±±μ ΨΘ©ΓΘ
(3)ΦΉΙηΆι(SiH4)Ω…”Οά¥÷Τ»Γ≥§¥ΩΑκΒΦΧεΙηΘ§ΙΛ“Β…œ≤…”ΟMg2SiΚΆNH4Cl‘Ύ“ΚΑ±Ϋι÷ ÷–Ζ¥”Π÷ΤΒΟΦΉΙηΆιΘ§ΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ___________ΓΘ
(4)ΧΦΥα«βΡΤΒΡ»ήΫβΕ»–Γ”ΎΧΦΥαΡΤΘ§ «”…”ΎHCO3-ΡήΙΜ–Έ≥…ΥΪΨέΜρΕύΨέΝ¥Ή¥άκΉ”ΒΡΫαΙϊΘ§HCO3-÷–C‘≠Ή”ΒΡ‘”Μ·ΖΫ ΫΈΣ_______Θ§HCO3-ΡήΙΜΥΪΨέΜρΕύΨέΒΡ‘≠“ρ «__________ΓΘ
(5) SiCΉςΈΣCΚΆSiΈ®“ΜΈ»Ε®ΒΡΜ·ΚœΈοΘ§ΟΩΗωSi(ΜρC)‘≠Ή””κ÷ή±ΏΑϋΈßΒΡC(Si)‘≠Ή”Ά®Ιΐ________‘”Μ·œύΜΞΫαΚœΓΘ“―Ψ≠ΖΔœ÷SiCΨΏ”–250Εύ÷÷–ΆΧεΓΘΡ≥ΝΔΖΫœΒΨßΧεΤδΨßΑϊ≤Έ ΐΈΣapmΘ§ΑΔΖϋΦ”Β¬¬ό≥Θ ΐΒΡ÷ΒΈΣNAΘ§ΗΟΨßΑϊ÷–‘≠Ή”ΒΡΉχ±ξ≤Έ ΐΈΣΘΚ
C≤ΩΖ÷‘≠Ή”ΘΚ(0Θ§0Θ§0)ΘΜ(![]() Θ§
Θ§![]() Θ§0)ΘΜ(
Θ§0)ΘΜ(![]() Θ§0Θ§
Θ§0Θ§![]() )ΘΜ(0Θ§
)ΘΜ(0Θ§![]() Θ§
Θ§![]() )
)
Si»Ϊ≤Ω‘≠Ή”ΘΚ(![]() Θ§
Θ§![]() Θ§
Θ§![]() )ΘΜ(
)ΘΜ(![]() Θ§
Θ§![]() Θ§
Θ§![]() )ΘΜ(
)ΘΜ(![]() Θ§
Θ§![]() Θ§
Θ§![]() )ΘΜ(
)ΘΜ(![]() Θ§
Θ§![]() )
)
ΗΟΝΔΖΫΨßΑϊ÷–Si‘≠Ή”ΙΙ≥…ΒΡΩ’ΦδΙΙ–ΆΈΣ_______Θ§ΨßΧεΒΡΟήΕ»Ω…±μ ΨΈΣ________g/cm3ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≥Θ”ΟΒςΈΕΦΝΜ®ΫΖ”Ά «“Μ÷÷¥”Μ®ΫΖΉ―÷–Χα»ΓΒΡΥ°’τΤχΜ”ΖΔ–‘œψΨΪ”ΆΘ§»ή”Ύ““¥ΦΓΔ““Ο―Β»”–Μζ»ήΦΝΓΘάϊ”Ο»γΆΦΥυ ΨΉΑ÷Ο¥ΠάμΜ®ΫΖΉ―ΖέΘ§Ψ≠Ζ÷άκΧα¥ΩΒΟΒΫΜ®ΫΖ”ΆΓΘ

Β―ι≤Ϋ÷ηΘΚ
Θ®“ΜΘ©‘ΎAΉΑ÷Ο÷–ΒΡ‘≤ΒΉ…’ΤΩ÷–ΉΑ»κ![]() »ίΜΐΒΡΥ°Θ§Φ”1~2ΝΘΖ– ·ΓΘΆ§ ±Θ§‘ΎB÷–ΒΡ‘≤ΒΉ…’ΤΩ÷–Φ”»κ20gΜ®ΫΖΉ―ΖέΚΆ50mLΥ°ΓΘ
»ίΜΐΒΡΥ°Θ§Φ”1~2ΝΘΖ– ·ΓΘΆ§ ±Θ§‘ΎB÷–ΒΡ‘≤ΒΉ…’ΤΩ÷–Φ”»κ20gΜ®ΫΖΉ―ΖέΚΆ50mLΥ°ΓΘ
Θ®ΕΰΘ©Φ”»»AΉΑ÷Ο÷–ΒΡ‘≤ΒΉ…’ΤΩΘ§Β±”–¥σΝΩ’τΤχ≤ζ…ζ ±ΙΊ±’Β·Μ…Φ–Θ§Ϋχ––’τΝσΓΘ
Θ®»ΐΘ©œρΝσ≥ω“Κ÷–Φ”»κ ≥―Έ÷Ν±ΞΚΆΘ§‘Ό”Ο15mL““Ο―ίΆ»Γ2¥ΈΘ§ΫΪΝΫ¥ΈίΆ»ΓΒΡΟ―≤ψΚœ≤ΔΘ§Φ”»κ…ΌΝΩΈόΥ°Na2SO4ΘΜΫΪ“ΚΧε«ψΒΙ»κ’τΝσ…’ΤΩ÷–Θ§’τΝσΒΟΜ®ΫΖ”ΆΓΘ
(1)ΉΑ÷ΟA÷–≤ΘΝßΙήΒΡΉς”Ο «_______ΓΘΉΑ÷ΟB÷–‘≤ΒΉ…’ΤΩ«ψ–±ΒΡΡΩΒΡ « ________ΓΘ
(2)≤Ϋ÷ηΘ®ΕΰΘ©÷–Θ§Β±Ιέ≤λΒΫ_______œ÷œσ ±Θ§Ω…ΆΘ÷Ι’τΝσΓΘ’τΝσΫα χ ±Θ§œ¬Ν–≤ΌΉςΒΡΥ≥–ρΈΣ_______Θ®Χν±ξΚ≈Θ©ΓΘ
ΔΌΆΘ÷ΙΦ”»»ΔΎ¥ρΩΣΒ·Μ…Φ–ΔέΙΊ±’άδΡΐΥ°
(3)‘ΎΝσ≥ω“Κ÷–Φ”»κ ≥―ΈΒΡΉς”Ο «__ ΘΜΦ”»κΈόΥ°Na2SO4ΒΡΉς”Ο «_______ΓΘ
(4) Β―ιΫα χΚσΘ§”ΟœΓNaOH»ή“Κ«εœ¥άδΡΐΙήΘ§Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_________ΓΘΘ®≤–ΝτΈο“‘![]() ±μ ΨΘ©
±μ ΨΘ©
(5)ΈΣ≤βΕ®Μ®ΫΖ”Ά÷–”Ά÷§ΒΡΚ§ΝΩΘ§»Γ20.00mLΜ®ΫΖ”Ά»ή”Ύ““¥Φ÷–Θ§Φ”80.00mL0.5mol/LNaOHΒΡ““¥Φ»ή“ΚΘ§ΫΝΑηΘ§≥δΖ÷Ζ¥”ΠΘ§Φ”Υ°≈δ≥…200mL»ή“ΚΓΘ»Γ25.00mLΦ”»κΖ”ΧΣΘ§”Ο0.1moI/L―ΈΥαΫχ––ΒΈΕ®Θ§ΒΈΕ®÷’ΒψœϊΚΡ―ΈΥα20.00mLΓΘ‘ρΗΟΜ®ΫΖ”Ά÷–Κ§”–”Ά÷§_______ g/LΓΘ
Θ®“‘ ΦΤΘ§ ΫΝΩΘΚ884)ΓΘ
ΦΤΘ§ ΫΝΩΘΚ884)ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΙΊ”ΎΒγΫβ÷ »ή“ΚΒΡ–π ω’ΐ»ΖΒΡ «(ΓΓΓΓ)
A. “Έ¬œ¬Θ§pHΘΫ7ΒΡNH4Cl”κΑ±Υ°ΒΡΜλΚœ»ή“Κ÷–άκΉ”≈®Ε»¥σ–ΓΥ≥–ρΈΣ:c(ClΘ≠)>c(NH![]() )>c(HΘΪ)ΘΫc(OHΘ≠)
)>c(HΘΪ)ΘΫc(OHΘ≠)
B. ΫΪpHΘΫ4ΒΡ¥ΉΥα»ή“ΚœΓ ΆΚσΘ§»ή“Κ÷–Υυ”–άκΉ”ΒΡ≈®Ε»ΨυΫΒΒΆ
C. ÷–ΚΆpH”κΧεΜΐΨυœύΆ§ΒΡ―ΈΥαΚΆ¥ΉΥα»ή“ΚΘ§œϊΚΡNaOHΒΡΈο÷ ΒΡΝΩœύΆ§
D. “Έ¬œ¬Θ§Ά§≈®Ε»ΒΡNa2S”κNaHS»ή“Κœύ±»Θ§Na2S»ή“ΚΒΡpH¥σ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com