
【题目】锆(![]() )是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是
)是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是![]() ,还含有少量
,还含有少量![]() 等杂质)为原料生产锆及其化合物的流程如图所示
等杂质)为原料生产锆及其化合物的流程如图所示

(1)写出![]() 的电子式____________________。
的电子式____________________。
(2)高温气化过程中,不考虑损失,发现分馏后得到的![]() 质量通常比由纯
质量通常比由纯![]() 发生的反应得到的
发生的反应得到的![]() 质量大,用化学方程式来解释原因_________________________。
质量大,用化学方程式来解释原因_________________________。
(3)高温气化后的固体残渣除碳外,还有![]() 和
和![]() ,加水浸取得氯化铁溶液,过滤,从滤渣中分离出碳和
,加水浸取得氯化铁溶液,过滤,从滤渣中分离出碳和![]() 两种固体的方法是____________________。
两种固体的方法是____________________。
(4)写出上述流程中![]() 与水反应的化学方程式:____________________________。
与水反应的化学方程式:____________________________。
(5)已知氧化锆(![]() )是一种两性氧化物,与氢氧化钠共熔融可形成酸盐,请写出化学方程式_________________________________________。
)是一种两性氧化物,与氢氧化钠共熔融可形成酸盐,请写出化学方程式_________________________________________。
(6)工业上可用钾还原![]() 时制得金属
时制得金属![]() ,
,![]() 被还原时生成的钾盐的物质的量为_________________。
被还原时生成的钾盐的物质的量为_________________。
(7)已知![]() ,
,![]() 。下列说法正确的是__________
。下列说法正确的是__________
A.![]() ,电解质溶液的
,电解质溶液的![]() 与
与![]() 之和均为14
之和均为14
B.用盐酸滴定某浓度的![]() 溶液,滴定过程中
溶液,滴定过程中![]() 逐渐增大
逐渐增大
C.![]() 溶液中逐滴加入硫酸溶液,滴加过程中
溶液中逐滴加入硫酸溶液,滴加过程中![]() 逐渐减小
逐渐减小
D.某温度下![]() ,则其溶液中
,则其溶液中![]()
【答案】
![]() 加入
加入![]() 溶液浸取过滤得碳,再向滤液通入二氧化碳后过滤,将固体加热得
溶液浸取过滤得碳,再向滤液通入二氧化碳后过滤,将固体加热得![]() (或先用盐酸浸取,再用氨水也可)
(或先用盐酸浸取,再用氨水也可) ![]()
![]()
![]()
![]()
【解析】
锆英石(主要成分为ZrSiO4,也可表示为ZrO2SiO2,还含少量Al2O3、SiO2、Fe2O3等杂质),通入足量的氯气以及和足量的石焦油反应,ZrSiO4转化为ZrCl4,加水水解,使ZrCl4转化为ZrOCl28H2O,900℃加热分解,即可得到ZrO2,加入镁置换得到海绵锆,据此分析作答。
(1)SiCl4分子中硅原子最外层有4个电子,能形成4个共价键达到稳定结构,每个氯原子能形成一个共价键达到稳定结构,电子式为: ,
,
故答案为: ;
;
(2)高温气化过程中,二氧化硅和氯气与碳反应生成氯化硅与一氧化碳,其化学方程式为:![]() ,
,
故答案为:![]() ;
;
(3)分离出碳和![]() ,从
,从![]() 的两性来分析,如先加入
的两性来分析,如先加入![]() 溶液浸取过滤得碳,再向滤液通入二氧化碳后过滤,将固体加热得
溶液浸取过滤得碳,再向滤液通入二氧化碳后过滤,将固体加热得![]() ;或先用盐酸浸取过滤得碳,再向滤液加入过量氨水得到沉淀,最后再加热得到
;或先用盐酸浸取过滤得碳,再向滤液加入过量氨水得到沉淀,最后再加热得到![]() ,
,
故答案为:加入![]() 溶液浸取过滤得碳,再向滤液通入二氧化碳后过滤,将固体加热得
溶液浸取过滤得碳,再向滤液通入二氧化碳后过滤,将固体加热得![]() (或先用盐酸浸取,再用氨水也可);
(或先用盐酸浸取,再用氨水也可);
(4)根据流程图可知ZrCl4与水反应产物为ZrOCl28H2O,根据原子守恒,反应方程式为:ZrCl4+9H2O═ZrOCl28H2O+2HCl,
故答案为:ZrCl4+9H2O═ZrOCl28H2O+2HCl;
(5)结合氧化铝的两性,根据已知条件可知,氧化锆(![]() )与氢氧化钠共熔融可形成酸盐的化学方程式为:
)与氢氧化钠共熔融可形成酸盐的化学方程式为:![]() ,
,
故答案为:![]() ;
;
(6)用钾还原![]() 时制得金属
时制得金属![]() ,根据氧化还原反应的规律得出其化学方程式为:K2ZrF6+4K=Zr+6KF,根据关系式得出若
,根据氧化还原反应的规律得出其化学方程式为:K2ZrF6+4K=Zr+6KF,根据关系式得出若![]() 被还原时生成的钾盐(KF)的物质的量为6mol,
被还原时生成的钾盐(KF)的物质的量为6mol,
故答案为:6mol;
(7) A.![]() ,根据水的离子积可知,
,根据水的离子积可知,![]() ×
×![]() =10-14,结合公式
=10-14,结合公式![]() 可推出,电解质溶液的
可推出,电解质溶液的![]() 与
与![]() 之和均为14,A项正确;
之和均为14,A项正确;
B. 用盐酸滴定某浓度的![]() 溶液,滴定过程中
溶液,滴定过程中![]() 逐渐减小,则
逐渐减小,则![]() ,B项正确;
,B项正确;
C.![]() 溶液中逐滴加入硫酸溶液,生成硫酸钡,滴加过程中
溶液中逐滴加入硫酸溶液,生成硫酸钡,滴加过程中![]() 逐渐减小,
逐渐减小,![]() 会逐渐增大,C项错误;
会逐渐增大,C项错误;
D. ![]() ,则溶液中c(Zr4+)·c2(CO32-)=4.0×10-12,则-lg c(Zr4+)·c2(CO32-)=12-2lg2,即pc(Zr4+)+2p c(CO32-)=11.4,D项错误;
,则溶液中c(Zr4+)·c2(CO32-)=4.0×10-12,则-lg c(Zr4+)·c2(CO32-)=12-2lg2,即pc(Zr4+)+2p c(CO32-)=11.4,D项错误;
答案选AB。


科目:高中化学 来源: 题型:
【题目】标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是
A. H2O(g)===H2+1/2O2(g)ΔH=-485 kJ·mol-1
B. H2O(g)===H2(g)+1/2O2(g) ΔH=+485 kJ·mol-1
C. 2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:25 ℃、101 kPa时,Mn(s)+O2(g)===MnO2(s) ΔH=-520 kJ·mol-1;S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1;Mn(s)+S(s)+2O2(g)===MnSO4(s) ΔH=-1 065 kJ·mol-1 SO2与MnO2反应生成无水MnSO4的热化学方程式是___________________________。
(2)已知:温度过高时,WO2(s)转变为WO2(g):①WO2(s)+2H2(g)![]() W(s)+2H2O(g) ΔH=+66.0 kJ·mol-1②WO2(g)+2H2(g)
W(s)+2H2O(g) ΔH=+66.0 kJ·mol-1②WO2(g)+2H2(g)![]() W(s)+2H2O(g) ΔH=-137.9 kJ·mol-1;则WO2(s)W
W(s)+2H2O(g) ΔH=-137.9 kJ·mol-1;则WO2(s)W![]() O2(g)的ΔH=______________
O2(g)的ΔH=______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)AlCl3溶液呈________性(填“酸”“中”或“碱”),原因是____________________________(用离子方程式表示)。把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是____________________(写化学式)。实验室在保存AlCl3溶液时,常在溶液中加少量的________,以抑制其水解。
(2)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈________性(填“酸”“中”或“碱”),溶液中[Na+]________[CH3COO-](填“>”“=”或“<”)。
(3)25 ℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈________性(填“酸”“中”或“碱”),溶液中,[Na+]________[CH3COO-](填“>”“=”或“<”)。
(4)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈________性(填“酸”“中”或“碱”),醋酸体积________氢氧化钠溶液体积(填“>”“=”或“<”)。
(5)已知0.1 mol·L-1的NaHCO3溶液pH=9,则溶液中[CO32-]________[H2CO3](填“>”“=”或“<”),其溶液显电中性的原因是________________________(用离子浓度关系式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. NaHCO3的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. 醋酸的电离:CH3COOH=CH3COO-+H+
C. H2的燃烧热为285.8 kJ/mol,则表示H2燃烧热的热化学方程式为:H2(g)+1/2O2(g)=H2O(g) ΔH=-285.8 kJ/mol
D. 碳酸钙的溶解平衡:CaCO3(s)![]() Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1 mol·Lˉ1的NaOH溶液和氨水,下列说法正确的是
A. c(NH3H2O) + c(NH4+) = c(Na+)
B. NH3的水溶液能导电,所以NH3是电解质
C. 氨水的pH大于NaOH溶液
D. 将浓度为0.1 mol·Lˉ1的盐酸和氨水等体积混合后,所得溶液中:c(OH-) > c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示示意图,下列说法不正确的是

A. 反应的热化学方程式可表示为C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B. 该反应过程反应物断键吸收的能量大于生成物成键放出的能量
C. a mol C和a mol H2O反应生成a mol CO和a mol H2吸收的热量一定为131.3a kJ
D. 1 mol C(g)、2 mol H、1 mol O转变成1 mol CO(g)和1 mol H2(g)放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁![]() 是一种补铁强化剂广泛用于缺铁性贫血的预防和治疗。某学习小组欲利用硫酸亚铁溶液与甘氨酸反应制备甘氨酸亚铁,有关物质性质如表:
是一种补铁强化剂广泛用于缺铁性贫血的预防和治疗。某学习小组欲利用硫酸亚铁溶液与甘氨酸反应制备甘氨酸亚铁,有关物质性质如表:
甘氨酸( | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程
实验1制备![]() :将含
:将含![]() 的溶液与
的溶液与![]() 溶液混合,反应结束后过滤并洗涤沉淀。
溶液混合,反应结束后过滤并洗涤沉淀。
实验2制备![]() :
:
实验装置如图(夹持和加热仪器已省略),将实验1得到的沉淀和含![]() 甘氨酸的水溶液混合后加入
甘氨酸的水溶液混合后加入![]() 中。利用
中。利用![]() 中的反应将
中的反应将![]() 中空气排净,接着滴入柠檬酸溶液并加热。
中空气排净,接着滴入柠檬酸溶液并加热。
实验3提纯![]() :反应结束后过,将滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品。
:反应结束后过,将滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品。
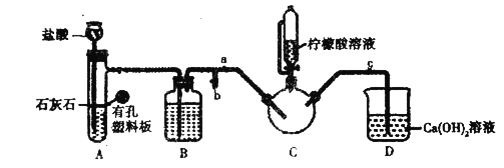
(1)写出实验1中制备![]() 的离子方程式_________________。
的离子方程式_________________。
(2)装盐酸的仪器名称是__________,装置![]() 中的试剂是__________。
中的试剂是__________。
(3)实验2中,打开![]() 关闭
关闭![]() ,排尽空气。确认
,排尽空气。确认![]() 中空气排尽的实验现象是________________,排尽空气后进行的实验操作是________,接着滴入柠檬酸溶液并加热。
中空气排尽的实验现象是________________,排尽空气后进行的实验操作是________,接着滴入柠檬酸溶液并加热。
(4)实验2中的柠酸可调节溶液![]() ,体系
,体系![]() 与产率的关系如表
与产率的关系如表
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
体系 | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 |
产率(%) | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 |
![]() 过低产率下降的原因是________________________;柠檬酸的作用还有_______。
过低产率下降的原因是________________________;柠檬酸的作用还有_______。
(5)实验3中加入乙醇的目的是____________________。
(6)若产品的质量为![]() ,则产率为__________________%。
,则产率为__________________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液中可能存在大量Ag+、Mg2+、Fe3+、Cu2+中的一种或几种,请填写下列空白。
(1)不用做任何实验就可以肯定溶液中不存在的离子是________________。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明原溶液中肯定存在的离子是________,有关反应的离子方程式为________________。
(3)取 (2)的滤液加过量的NaOH溶液,出现白色沉淀,说明原溶液中肯定有________,有关反应的离子方程式为________________。
(4)原溶液中可能大量存在的阴离子是________(填序号)。
A.Cl- B.NO![]() C. CO
C. CO![]() D.OH-
D.OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com