
����Ŀ��������ѧ֪ʶ�ش���������:
��1��A��NaOH��Һ��Ӧ��������ת����ϵ(����������ˮ������ʡ�ԣ�δ��ʾ����)��

����AΪ�����������ʣ�CΪ���壬д����B��Һ��ͨ�����CO2��Ӧ�����ӷ���ʽ:_______________��
����AΪ�����ijɷ�֮һ�����������ЧӦ������100mL1mol/LNaOH��Һ��ͨ��1.344L����(��״����)��ַ�Ӧ������B��C�����ʵ���֮��Ϊ______(B��Ħ����������C)��
����AΪAlCl3��д��A��NaOH�����ʵ���֮��3:10���ʱ������Ӧ�����ӷ���ʽ:______________��
��2���Ȼ�����Һ�����ڸ�ʴӡˢͭ��·�壬��д����ص����ӷ���ʽ: ______________����μ�����Һ�е��������Ѿ���ȫ��Ӧ: ______________��
��3������AlCl3��FeCl3�����Һ,����A13+��Fe3+�����ʵ���֮��Ϊ0.1mol�������Һ�м���80mLŨ��Ϊ4mol/L��NaOH��Һ��ʹ���ַ�Ӧ����ԭ�����Һ��A13+�����ʵ�����A13+��Fe3+�������ʵ����ı�ֵΪx�����������ɵij�����ֻ��Fe(OH)3ʱ��x��ȡֵ��Χ��______������ͼ�л�����������(mol)��x(0��1.0)�仯������:______________

���𰸡� AlO2-+CO2+2H2O=HCO3-+Al(OH)3�� 2:1 3A13++10OH-=2Al(OH)3��+AlO2-+2H2O Cu+2Fe3+=2Fe2++Cu2+ ȡ�����μ�1~2�����軯����Һ����Һ����죬���������Ѿ���ȫ��Ӧ 0<x��0.2 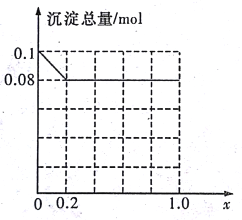
��������(1)����AΪ�����������ʣ���AΪ����CΪ���壬CΪ������BΪƫ�����ƣ���ƫ��������Һ��ͨ�����CO2��Ӧ������������������̼�����ƣ���Ӧ�����ӷ���ʽΪAlO2-+CO2+2H2O=HCO3-+Al(OH)3�����ʴ�Ϊ��AlO2-+CO2+2H2O=HCO3-+Al(OH)3����
����AΪ�����ijɷ�֮һ�����������ЧӦ����AΪ������̼��100mL1mol/LNaOH��Һ�к�����������0.1mol����״����1.344L������̼�����ʵ���Ϊ![]() =0.06mol���������ɵ�̼����Ϊxmol��̼������Ϊymol������̼ԭ���غ����ԭ���غ���x+y=0.06mol��2x+y=0.1mol�����x=0.04��y=0.02��B��Ħ����������C����BΪ̼���ƣ�CΪ̼�����ƣ�B��C�����ʵ���֮��=0.04mol��0.02mol=2:1���ʴ�Ϊ��2:1��
=0.06mol���������ɵ�̼����Ϊxmol��̼������Ϊymol������̼ԭ���غ����ԭ���غ���x+y=0.06mol��2x+y=0.1mol�����x=0.04��y=0.02��B��Ħ����������C����BΪ̼���ƣ�CΪ̼�����ƣ�B��C�����ʵ���֮��=0.04mol��0.02mol=2:1���ʴ�Ϊ��2:1��
����AΪAlCl3���Ȼ�������NaOH�����ʵ���֮��3:10���ʱ������������������ƫ�����ƣ���Ӧ�����ӷ���ʽΪ3A13++10OH-=2Al(OH)3��+AlO2-+2H2O���ʴ�Ϊ��3A13++10OH-=2Al(OH)3��+AlO2-+2H2O��
(2)�Ȼ�����ͭ����������ԭ��Ӧ�������Ȼ��������Ȼ�ͭ����Ӧ�����ӷ���ʽΪCu+2Fe3+=2Fe2++Cu2+��Ҫ֤����Һ�е��������Ѿ���ȫ��Ӧ��ֻ��Ҫ֤����Һ��û�������Ӽ��ɣ�������ȡ�����μ�1~2�����軯����Һ����Һ����죬���������Ѿ���ȫ��Ӧ���ʴ�Ϊ��Cu+2Fe3+=2Fe2++Cu2+��ȡ�����μ�1~2�����軯����Һ����Һ����죬���������Ѿ���ȫ��Ӧ��
(3)80mL 4mol/L��NaOH��Һ�к�����������0.32mol��Fe3+�����ʵ���Ϊ0.1mol��(1-x)�����ĵ�OH-���ʵ���Ϊ0.1mol��(1-x)��3��Fe3+��Ӧ��ʣ���OH-���ʵ���Ϊ0.32mol-0.1mol��(1-x)��3����������Al(OH)3����0.32mol-0.1mol��(1-x)��3��0.1mol��x��4�����x��0.2����0��x��0.2����0��x��0.2ʱ������ֻ��Fe(OH)3��Fe(OH)3������Ϊ0.1mol��(1-x)=0.1mol-0.1xmol��0.2��x��1ʱ����������Ϊ��0.1mol��(1-x)+0.1mol��x-(0.32mol-0.1mol��3)=0.08mol��
�ʳ�������(mol)��x(0��1.0)�仯������Ϊ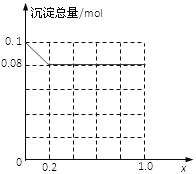 ���ʴ�Ϊ��0��x��0.2��
���ʴ�Ϊ��0��x��0.2�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ��������Na2O���ʵ�Na2O2����,����ͼ��ʾ��ʵ��װ�òⶨNa2O2�����Ĵ��ȡ�(�ɹ�ѡ�õ��Լ�ֻ��CaCO3���塢6 mol��L-1���ᡢ6 mol��L-1���������ˮ)
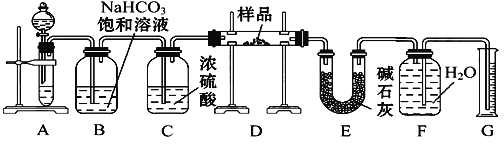
�ش���������:
��1��װ��A��Һ���Լ�ѡ��____ ��ʵ�鿪ʼǰʢװ��ҩƷ������������_____ ��B�б���NaHCO3 ��Һ�ܷ��Ϊ����Na2CO3 ��Һ ______
��2��װ��B��������________��װ��C��������________��װ��E�м�ʯ�ҵ�������___________��
��3��װ��D�з�������Ҫ��Ӧ�Ļ�ѧ����ʽ��_________ �����F���ռ����������� _____
��4����ɾȥEװ�ã��ֻ���ʲô�����______����ƫ�ߡ�ƫ�ͻ���Ӱ�죩��
��5������ʼʱ�����Ʒ������Ϊ2.0 g,��Ӧ���������������Ϊ224 mL(��״��),��Na2O2�����Ĵ���Ϊ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ɹ⻯ѧ�����ͳ�������ĵ���Ҫ���壮
��֪����CO��g��+NO2��g���TNO��g��+CO2��g����H=��akJmol��1��a��0��
��2CO��g��+2NO��g���TN2��g��+2CO2��g����H=��bkJmol��1��b��0��
���ñ�״����4.48L CO��ԭNO2��N2��CO��ȫ��Ӧ��������������ת�Ƶ��ӵ����ʵ���Ϊ �� �ų�������ΪkJ���ú���a��b�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ���Ũ����ͬ���������ʵ�ˮ��Һ��������ǿ����
A��HCl B��H2SO4 C��CH3COOH D��NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з������ܴﵽԤ��Ŀ�ĵ���
A. ��KMnO4������Һ������ϩ��CO2 B. ��pH��ֽ����NaCl��Һ��HCl��Һ
C. �ù۲������ɫ�ķ�������ͭ������� D. ��KOH��Һ����Na2CO3��KNO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ����dz�����ˮ�����������÷���м���Ʊ���ˮ�Ȼ�����ʵ�����Ʊ�װ�ú�ҵ�Ʊ�����ͼ��ͼ��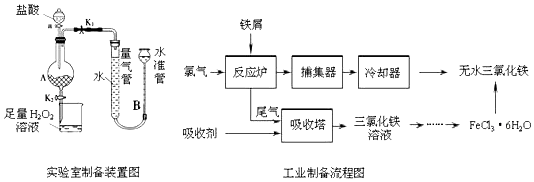
��֪������ˮFeCl3���۵�Ϊ555K���е�Ϊ588K��
�ڷ���м�е����ʲ������ᷴӦ
�۲�ͬ�¶�����ˮ���Ȼ�����ˮ�е��ܽ�������
�¶�/�� | 0 | 20 | 80 | 100 |
�ܽ�ȣ�g/100 g H2O�� | 74.4 | 91.8 | 525.8 | 535.7 |
ʵ�����Ʊ������������£�
����ɼ�K1 �� �رյ��ɼ�K2 �� ������a�������μ����ᣮ
��װ��A�в��������ݻ������ܺ�ˮ��Һ�治��ʱ���رյ��ɼ�K1 �� ���ɼ�K2 �� ��A����Һ��ȫ�����ձ���رջ���a��
���ձ�����Һ����һϵ�в�����õ�FeCl36H2O���壮
��1���ձ���������H2O2��Һ�������� ��
��2��Ϊ�˲ⶨ����м�����������������������С������������� ��
��3����FeCl3��Һ�Ƶ�FeCl36H2O����IJ��������ǣ�����������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����
��4����д���������з�Ӧ�����ӷ���ʽ�� ��
��5���������¶ȳ���673Kʱ��������Է�������Ϊ325�������Ȼ�������ʵķ���ʽΪ
��6��FeCl3����������ͨ�����õ������ⶨ����ȡm g��ˮ�Ȼ�����Ʒ������ϡ���ᣬ���Ƴ�100mL��Һ��ȡ��10.00mL�������Թ�����KI��Һ����ַ�Ӧ���뼸�ε�����Һ������c molL��1 Na2S2O3��Һ�ζ�������V mL����֪��I2+2S2O32���T2I��+S4O62������
�ٵζ������п������ʵ����ƫ�͵���
A����ƿδ��ϴ B����ƿ����Һ��ɫ������ֹͣ�ζ������ж���
C���ζ��ܼ����ڵζ�ǰ�����ݣ��ζ��յ㷢������ D���ζ��յ�ʱ���Ӷ���
����Ʒ���Ȼ���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ���ʾ10mL��Ͳ��Һ���λ�ã�A��B��B��C�̶ȼ����1mL������̶�AΪ6����Ͳ��Һ��������mL��
��ͼ���ʾ50mL�ζ�����Һ���λ�ã����Һ�洦�� ������a����ζ�����Һ������������ţ� ��
A����a mL B��һ������a mL
C���ǣ�50��a�� mL D��һ�����ڣ�50��a�� mL��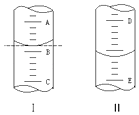
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100mL HNO3��H2SO4�Ļ����Һ�У�����������ʵ���Ũ��֮��Ϊ0.6mol/L�������Һ�м���������ͭ�ۣ����ȣ���ַ�Ӧ��������Һ��Cu2+�����ʵ���Ũ�����ֵΪ����Ӧǰ����Һ����仯���Բ��ƣ��� ��
A.0.225mol/L
B.0.30mol/L
C.0.36mol/L
D.0.45mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����������ˮ�м�����ɫʯ����Һ��������________________��˵����ˮ�к��У��ѧʽ�����ӷ��ţ�____________������ˮ�м���NaHCO3��Һ������Ӧ�����ӷ���ʽΪ______________________��
��2����ȡƯ�۵Ļ�ѧ��Ӧ����ʽΪ______________________________________����Ӧ���������뻹ԭ����������Ϊ_________��Ư�۵���Ч�ɷ���________�����ڿ����б��ʵ�ԭ���ǣ��û�ѧ����ʽ��ʾ��_______________________��______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com