
脱水偶联反应是一种新型的直接烷基化反应,例如:
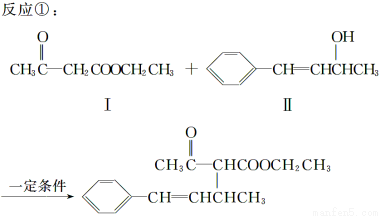
(1)化合物Ⅰ的分子式为________,1 mol该物质完全燃烧最少需要消耗________ mol O2。
(2)化合物Ⅱ可使________溶液(限写一种)褪色;化合物Ⅲ(分子式为C10H11Cl)可与NaOH水溶液共热生成化合物Ⅱ,相应的化学方程式为__________。
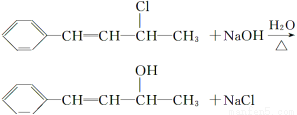
(3)化合物Ⅲ与NaOH乙醇溶液共热生成化合物Ⅳ,Ⅳ的核磁共振氢谱除苯环峰外还有四组峰,峰面积之比为1∶1∶1∶2,Ⅳ的结构简式为__________。
(4)由CH3COOCH2CH3可合成化合物Ⅰ,化合物Ⅴ是CH3COOCH2CH3的一种无支链同分异构体,碳链两端呈对称结构,且在Cu催化下与过量O2反应生成能发生银镜反应的化合物Ⅵ,Ⅴ的结构简式为__________,Ⅵ的结构简式为______________。
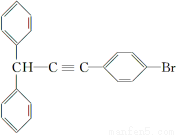
(5)一定条件下,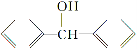 与
与
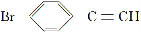 也可以发生类似反应①的反应,有机产物的结构简式为__________。
也可以发生类似反应①的反应,有机产物的结构简式为__________。
(1)C6H10O3 7
(2)溴水或酸性KMnO4溶液或溴的CCl4溶液
(3) 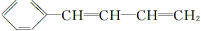
(4)HOCH2CHCHCH2OH
OHCCHCHCHO
(5)
【解析】(1)化合物Ⅰ的分子式为C6H10O3,根据x+y/4-z/2得,1 mol该物质完全燃烧最少需要消耗O2的物质的量为6+10/4-3/2=7 mol。
(2)在化合物Ⅱ中含有碳碳双键,所以能使溴水或酸性KMnO4溶液或溴的CCl4溶液褪色,C10H11Cl与NaOH溶液共热生成化合物Ⅱ,所以化合物Ⅲ的结构简式为CHCHCHClCH3。
(3)CHCHCHClCH3与NaOH乙醇溶液共热发生消去反应,其产物的结构简式为CHCHCHCH2或CHCCHCH3,除苯环外,符合峰面积之比为1∶1∶1∶2的是前者。
(4)化合物Ⅴ应为含有碳碳双键的二元醇,其结构简式为HOCH2CHCHCH2OH,Ⅵ的结构简式为OHCCHCHCHO。
(5)抓住题干中“脱水偶联反应”这一信息,应是CHOH提供羟基,BrC≡CH提供“炔氢”生成水,即生成CHC≡CBr。


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源:2014高考化学二轮专题突破 专题四氧化还原反应练习卷(解析版) 题型:填空题
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO+4H++3e-=NO↑+2H2O;KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:__________________________________。
(2)反应中硝酸体现了______________、______________的性质。
(3)反应中若产生0.2 mol气体,则转移的电子的物质的量是________ mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十五综合实验探究练习卷(解析版) 题型:填空题
氯酸镁晶体[Mg(ClO3)2·6H2O]可用作棉花收获前脱叶剂、小麦催熟剂、除草剂、干燥剂。实验室制备少量Mg(ClO3)2的操作步骤如下:
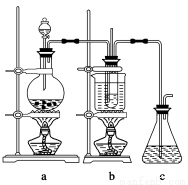
(1)制备NaClO3晶体:在实验室里可用如图所示装置制取NaClO3。图中:a为氯气发生装置;b为NaClO3的制备装置;c为尾气吸收装置。
①装置a中反应的离子方程式为____________________________
②工业上用石灰乳代替烧碱溶液吸收尾气的原因是___________________________
③装置b中发生反应的化学方程式为3Cl2+6NaOH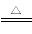 5NaCl+NaClO3+3H2O,请推测在加热NaClO溶液时发生反应的化学方程式:______________________________。
5NaCl+NaClO3+3H2O,请推测在加热NaClO溶液时发生反应的化学方程式:______________________________。
(2)制备氯酸镁晶体:由上述提纯制得的NaClO3和MgCl2按化学反应方程式计量数之比混合可制得Mg(ClO3)2,原理为MgCl2+2NaClO3=Mg(ClO3)2+2NaCl。已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
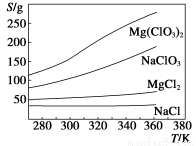
请补充由(1)制得的NaClO3制备Mg(ClO3)2·6H2O的操作步骤:
①按计量数之比将MgCl2和NaClO3混合溶于85 ℃的热水中,加热蒸发;
②______________________;
③______________________;
④重结晶。
(3)问题讨论:①用60 ℃ Na2CO3溶液吸收Cl2也可制得NaClO3,请写出该反应的化学方程式:__________________________________________。
②制备氯酸镁晶体时最后进行重结晶操作的目的是___________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十二常见非金属元素练习卷(解析版) 题型:选择题
将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如下图所示,图中AB段表示的离子方程式先后顺序正确的是( )
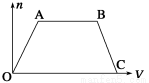
①CO2+OH-=HCO3— ②CO2+2OH-=CO32—+H2O
③CO32—+Ba2+=BaCO3↓ ④BaCO3+CO2+H2O=Ba2++2HCO3— ⑤CO32—+CO2+H2O=2HCO3—
A.③① B.②⑤ C.⑤④ D.④②
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十三无机化学综合应用练习卷(解析版) 题型:选择题
有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常见的无机试剂。E的溶质是一种无色油状液体,B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其他五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3沉淀均不溶。
根据上述实验信息,下列说法错误的是( )
A.B可能为NaHCO3溶液
B.F为AgNO3溶液
C.D不可能是镁或铝的盐酸盐
D.A为氨水,E为硫酸
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:填空题
单质A与粉末化合物B组成的混合物能发生如图所示的一系列反应:
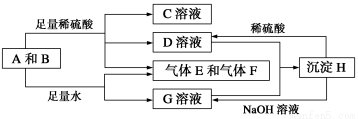
请回答下列问题:
(1)组成A单质的元素在周期表中处于第__________周期__________族。
(2)化合物B的电子式为________________________。
(3)D与G两溶液混合后发生反应的离子方程式为______________________________
(4)常温下,D溶液的pH________7(填“>”、“<”或“=”),其原因是____________________________(用离子方程式表示)。
(5)10.8 g A单质与足量的NaOH溶液反应,消耗氧化剂的质量为________ g。
(6)用碳棒、稀硫酸、气体E和气体F组成燃料电池,该电池的正极反应式为______________________。以该电池为电源,用惰性电极电解100 g 8%的C溶液,电解到溶质的质量分数为12.5%时停止电解,则电解过程中,生成的气体在准状况下的体积共为________ L,电路上通过电子的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:选择题
下图为与水相关的部分转化关系(水作反应物或生成物,部分产物和反应条件未列出)。下列说法错误的是( )
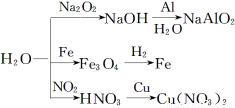
A.如图所示的反应均为氧化还原反应
B.比较镁、铁与水的反应条件,可知铁的金属性比镁弱
C.工业上常用NO2与水的反应原理制取硝酸
D.实验室中可用铜与稀硝酸反应制取NO2
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题六物质结构和元素周期律练习卷(解析版) 题型:选择题
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一。下列说法正确的是( )
A.原子半径的大小顺序:rX>rY>rW>rQ
B.X、Y的最高价氧化物的水化物之间不能反应
C.Z、W最外层电子数都为6,最高化合价都为+6价
D.元素Q和Z能形成QZ2型的共价化合物
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题二化学用语及常用计量练习卷(解析版) 题型:选择题
下列说法中正确的是( )
A.6.8 g熔融KHSO4与3.9 g熔融Na2O2中阴离子数目相同
B.某金属阳离子的结构示意图为 ,其与Cl-形成的强电解质都是离子化合物
,其与Cl-形成的强电解质都是离子化合物
C.二硫化碳是直线形非极性分子,其电子式为
D.中子数为18的氯原子可表示为18Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com