
单质A与粉末化合物B组成的混合物能发生如图所示的一系列反应:
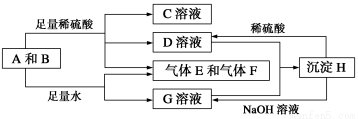
请回答下列问题:
(1)组成A单质的元素在周期表中处于第__________周期__________族。
(2)化合物B的电子式为________________________。
(3)D与G两溶液混合后发生反应的离子方程式为______________________________
(4)常温下,D溶液的pH________7(填“>”、“<”或“=”),其原因是____________________________(用离子方程式表示)。
(5)10.8 g A单质与足量的NaOH溶液反应,消耗氧化剂的质量为________ g。
(6)用碳棒、稀硫酸、气体E和气体F组成燃料电池,该电池的正极反应式为______________________。以该电池为电源,用惰性电极电解100 g 8%的C溶液,电解到溶质的质量分数为12.5%时停止电解,则电解过程中,生成的气体在准状况下的体积共为________ L,电路上通过电子的物质的量为________ mol。
(1)三 ⅢA (2) 。
。
(3)Al3++3AlO2—+6H2O=4Al(OH)3↓
(4)< Al3++3H2O Al(OH)3+3H+
Al(OH)3+3H+
(5)21.6 (6)O2+4H++4e-=2H2O 67.2 4
【解析】沉淀H既能与稀硫酸反应,又能与NaOH溶液反应,而D、G两溶液混合可以生成沉淀H,故推测H为两性氢氧化物Al(OH)3。故A为Al,B为Na2O2,C、D、G分别为Na2SO4、Al2(SO4)3、NaAlO2。(5)铝与氢氧化钠溶液反应的氧化剂是水,0.4 mol铝转移电子数为1.2 mol,消耗水的物质的量为1.2 mol,则水的质量为18 g·mol-1×1.2 mol=21.6 g。(6)电解Na2SO4溶液,实际上是电解水,溶质质量不变,8 g/12.5%=64 g,则被电解的水的质量为36 g(2 mol)。电解水的化学方程式为2H2O 2H2↑+O2↑,即消耗2 mol H2O共生成3 mol的气体,标准状况下体积为67.2 L,共转移4 mol e-。
2H2↑+O2↑,即消耗2 mol H2O共生成3 mol的气体,标准状况下体积为67.2 L,共转移4 mol e-。


科目:高中化学 来源:2014高考化学二轮专题突破 专题四氧化还原反应练习卷(解析版) 题型:选择题
已知NaCN溶液呈碱性,(CN)2与卤素单质的性质相似,CN-的还原性介于Br-、I-之间。下列变化不能发生的是( )
A.HCN H++CN-
H++CN-
B.(CN)2+CH2=CH2―→NC—CH2—CH2—CN
C.(CN)2+2Br-=2CN-+Br2
D.(CN)2+2OH-=CN-+CNO-+H2O
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十五综合实验探究练习卷(解析版) 题型:实验题
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验,可选用试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水。
(1)请完成下表:
操作 | 现象 | 结论 |
取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 |
| 存在Fe3+ |
取少量除尽Ag+后的溶液于试管中,加入________,振荡 |
| 存在Fe2+ |
【实验结论】 Fe的氧化产物为Fe2+和Fe3+。
Ⅱ.AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色。
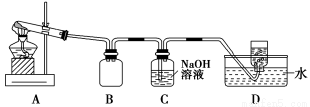
(2)装置B的作用是________。
(3)经小组讨论并验证该无色气体为O2,其验证方法是________。
(4)【查阅资料】 Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水。
【提出设想】 试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O。
【实验验证】 该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验。
实验编号 | 操作 | 现象 |
a | 加入足量氨水,振荡 | 黑色固体不溶解 |
b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验评价】 根据上述实验,不能确定固体产物成分的实验是________(填实验编号)。
【实验结论】 根据上述实验结果,该小组得出AgNO3固体热分解的产物有________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十三无机化学综合应用练习卷(解析版) 题型:实验题
氯气是一种重要的化工原料。某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
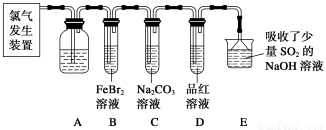
(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有__________________。
(2)装置A中盛有的试剂是________,作用是___________________________________。
(3)若D中品红溶液褪色,则B装置中发生反应的离子方程式是________________。
(4)证明FeBr2与Cl2发生了氧化还原反应的实验方法是__________(填操作方法)。
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气。经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32—和SO42—,对于可能存在的其他阴离子,研究小组提出以下3种假设。假设1:只存在SO32—;假设2:只存在ClO-;假设3:既不存在SO32—,也不存在ClO-。
(5)学习小组判断同时存在SO32—和ClO-是不可能的理由是_____________________。
(6)现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论。
a.3 mol·L-1 H2SO4 b.0.01 mol·L-1 KMnO4
c.1 mol·L-1 BaCl2溶液 d.淀粉碘化钾溶液
e.酚酞试液
步骤一:取少量吸收液于试管中,滴加3 mol·L-1 H2SO4至溶液呈中性,然后将所得溶液分装于A、B两试管中。
步骤二:向A试管中滴加少量__________(填序号),若溶液____________________(填现象),则假设1成立。
步骤三:向B试管中滴加少量__________(填序号),若溶液____________________(填现象),则假设2成立。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十七有机化学基础练习卷(解析版) 题型:填空题
脱水偶联反应是一种新型的直接烷基化反应,例如:
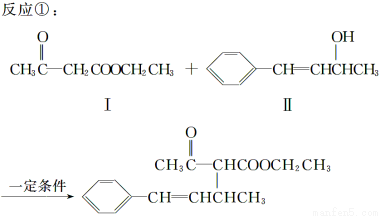
(1)化合物Ⅰ的分子式为________,1 mol该物质完全燃烧最少需要消耗________ mol O2。
(2)化合物Ⅱ可使________溶液(限写一种)褪色;化合物Ⅲ(分子式为C10H11Cl)可与NaOH水溶液共热生成化合物Ⅱ,相应的化学方程式为__________。
(3)化合物Ⅲ与NaOH乙醇溶液共热生成化合物Ⅳ,Ⅳ的核磁共振氢谱除苯环峰外还有四组峰,峰面积之比为1∶1∶1∶2,Ⅳ的结构简式为__________。
(4)由CH3COOCH2CH3可合成化合物Ⅰ,化合物Ⅴ是CH3COOCH2CH3的一种无支链同分异构体,碳链两端呈对称结构,且在Cu催化下与过量O2反应生成能发生银镜反应的化合物Ⅵ,Ⅴ的结构简式为__________,Ⅵ的结构简式为______________。
(5)一定条件下,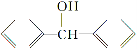 与
与
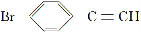 也可以发生类似反应①的反应,有机产物的结构简式为__________。
也可以发生类似反应①的反应,有机产物的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:选择题
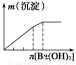
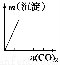
下列实验与对应示意图的关系正确的是( )
ABCD
NaAlO2溶液中逐滴滴加盐酸至过量AlCl3溶液中逐滴滴加氨水至过量 明矾溶液中逐滴滴加Ba(OH)2溶液至过量 澄清石灰水中缓慢通入CO2至过量
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:选择题
工业上冶炼金属一般用热分解法、热还原法和电解法,不同的金属应选用不同的冶炼方法。选择的原则主要是依据( )
A.金属在地壳中的丰度
B.金属在自然界中的存在形式
C.金属的还原性强弱
D.金属的利用价值
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题八电化学练习卷(解析版) 题型:填空题
海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mg·L-1 | 9 360 | 83 | 200 | 1 100 | 16 000 | 1 200 | 118 |
(1)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。
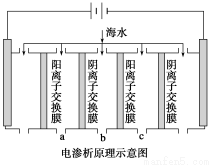
①阴极的电极反应式为__________________。
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式______________________________________。
③淡水的出口为a、b、c中的________出口。
(2)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如下图所示:
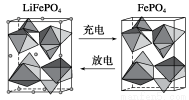
该电池电解质为传导Li+的固体材料。放电时该电极是电池的________极(填“正”或“负”),电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题九化学反应速率化学平衡练习卷(解析版) 题型:选择题
某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图Ⅰ所示,若其它条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是( )
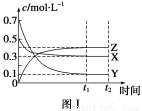
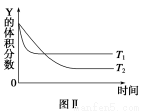
A.该反应的热化学方程式为X(g)+3Y(g)  2Z(g) ΔH>0
2Z(g) ΔH>0
B.若其它条件不变,升高温度,正、逆反应速度均增大,X的转化率减小
C.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
D.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com