
��12�֣���һ��2L���ܱ������У�Ͷ�뷴Ӧ�������Ӧ2SO3(g) 2SO2(g)��O2(g) ��H��0������SO3�ı仯����ͼ��ʾ��
2SO2(g)��O2(g) ��H��0������SO3�ı仯����ͼ��ʾ��

��1��д���÷�Ӧ��ƽ�ⳣ������ʽ������8minʱ����ƽ��������� ��
��2����O2��ʾ0��8min�ڸ÷�Ӧ��ƽ������v= ��
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬���� ��
A��v(SO3)=2v(O2) B��������ѹǿ���ֲ���
C��v(SO2)��=2v(O2)�� D���������ܶȱ��ֲ���
��4���ڵ�12minʱ������ѹ����1L����SO3�ı仯����Ϊ ��
A��a B��b C��c D��d
��5���������ݻ������ڵ�12minʱ������SO3(g)����ƽ���� ��Ӧ�����ƶ�����������桱����SO3��������� �������С������
��1��K=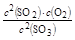 = 0.4 ��2��0.0125 mol/(L��min)
= 0.4 ��2��0.0125 mol/(L��min)
��3��B��C ��4��C ��5���� ����
��������
�����������1��K=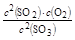 ��8����ʱc(SO3)=0.1mol/L����c(SO2)=0.2mol/L��c(O2)=0.1mol/L������K=0.4��
��8����ʱc(SO3)=0.1mol/L����c(SO2)=0.2mol/L��c(O2)=0.1mol/L������K=0.4��
��2��v(O2)=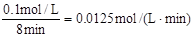
��3����Ӧǰ��ѹǿ���ȣ����Կ�����ѹǿ���ٱ仯�жϷ�Ӧ��ƽ�⣬v(SO2)��=2v(O2)�������淴Ӧ������ȣ������жϷ�Ӧ��ƽ�⣬���ѡBC��
��4������ѹ����˲�䣬SO3���ʵ������䣬�漴ƽ�������ƶ���SO3�����ʵ�����������c���߷��ϡ�
��5���������ݻ������ڵ�12minʱ������SO3(g)���൱�ڶ���ϵ��ѹ��ƽ�������ƶ�����SO3�������������
���㣺��ѧƽ���ƶ�
����������dz�������ֻҪ����Ӱ��ƽ���ƶ������ؼ��ɡ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ij�¶�ʱ����һ��2L���ܱ������У�X��Y��Z������̬���ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������˵���ڲ���ȷ���ǣ�������
ij�¶�ʱ����һ��2L���ܱ������У�X��Y��Z������̬���ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������˵���ڲ���ȷ���ǣ��������鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com