
【题目】已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是( )
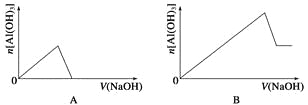
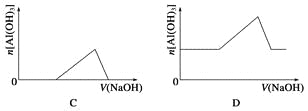
【答案】C
【解析】浓度均为0.1molL-1的Fe(NO3)3和Al(NO3)3混合溶液中,溶液中铁离子、铝离子的浓度相同为0.1mol/L,Al(OH)3的Ksp或溶解度远大于Fe(OH)3,故向混合溶液逐滴加入NaOH溶液,铁离子首先转化为氢氧化铁沉淀,当铁离子完全沉淀,铝离子再转化为氢氧化铝沉淀,当铝离子沉淀完全,再加入氢氧化钠,氢氧化铝溶解,沉淀的质量减少,由于氢氧化铁不溶于碱,故沉淀减少到一定值不再变化,为氢氧化铁的物质的量;A.向混合溶液逐滴加入NaOH溶液,铁离子首先转化为氢氧化铁沉淀,当铁离子完全沉淀,铝离子再转化为氢氧化铝沉淀,故开始加入氢氧化钠溶液不能立即产生氢氧化铝沉淀,图象与实际不相符,故A错误;B.向混合溶液逐滴加入NaOH溶液,铁离子首先转化为氢氧化铁沉淀,当铁离子完全沉淀,铝离子再转化为氢氧化铝沉淀,故开始加入氢氧化钠溶液不能立即产生氢氧化铝沉淀,图象与实际不相符,故B错误;C.铁离子首先转化为氢氧化铁沉淀,当铁离子完全沉淀,铝离子再转化为氢氧化铝沉淀,当铝离子沉淀完全,再加入氢氧化钠,氢氧化铝溶解,图象与实际相符合,故C正确;D.加入氢氧化钠一定体积后才会产生氢氧化铝沉淀,故D错误;故选C。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】下列是4位同学在学习“化学反应速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将碳酸钠和碳酸氢钠的混合物27.4g,加热到质量不再变化时剩余物质的质量为21.2g。再另取试样27.4g,加入某浓度盐酸100ml,恰好完全反应。(书写计算过程,否则记零分)
(1)求混合物中Na2CO3和NaHCO3的质量。
(2)计算盐酸的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验从海带中提取碘
①滴加稀硫酸和双氧水
②在海带中加入少量酒精,点燃使其燃烧为灰烬,在灰烬中加水搅拌;
③加四氯化碳并振荡
④过滤
⑤分液。
该实验的合理操作顺序是
A. ①③⑤②④ B. ②①③④⑤ C. ②④①③⑤ D. ③①②⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于合金性质的说法中,错误的是 ( )
A.多数合金的硬度一般比其各成分金属的硬度高
B.多数合金的熔点一般比其各成分金属的熔点低
C.合金的物理性质一般与其各成分金属的的物理性质不同
D.合金的化学性质一般与其各成分金属的的化学性质不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 烧瓶、锥形瓶、蒸发皿加热时均需要垫上石棉网
B. 分液漏斗、滴定管、容量瓶使用前均需要检查是否漏水
C. 配制1 mol·L-1 NaCl溶液、测定Na2CO3溶液的pH、焰色反应实验均需要用到玻璃棒
D. 量取25.00ml某盐酸,可以用量筒或者酸式滴定管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在工农业生产中有着吸要的应用.
(l)已知:2SO2(g)+O2═2SO3(g)△H=-196.6kJmol-1,2NO(g)+O2═2NO2(g)△H=-113.0kJmol-1.则反应NO2(g)+SO2(g)═SO3(g)+NO(g)的△H= _________;
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料.已知As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O.当生成H3AsO4的物质的量为0.6mol,反应中转移电子的数目为_________。
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS-、S2-的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出),滴加过程中,溶液中微位浓度大小关系正确的是_________ (填字母)。
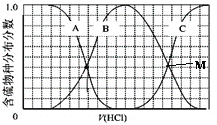
A.c(Na+)=c(H2S)+c(HS-)+2c(S2-)
B.2c(Na+)=c(H2S)+c(HS-)+c(S2-)
C.c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
(4)某学习小组以SO2为原料,采用电化学方法制取硫酸。该小组设计的原电池原理如图2所示.写出该电池负极的电极反应式_________;
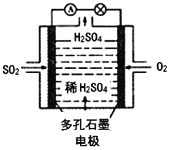
(5)难溶物ZnS遇CuSO4认溶液会慢慢转化为铜蓝(CuS)。若转化后溶液中c(Zn2+)=3.0×10-2molL-1,则c(Cu2+)= _________ molL-1〔已知Ksp(CuS)=1.0×10-36,Ksp(ZnS)=1.0×10-24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的盐酸与过量的铁粉反应时,为了减缓反应速率且不影响生成氢气的总量,可向盐酸中加入适量的 ①NaOH固体;②Na2SO4溶液;③KNO3溶液;④H2O;⑤CaCO3固体;⑥NaCl固体
A. ①②⑤ B. ②③⑥ C. ②③④⑤ D. ②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com