
【题目】一定量的盐酸与过量的铁粉反应时,为了减缓反应速率且不影响生成氢气的总量,可向盐酸中加入适量的 ①NaOH固体;②Na2SO4溶液;③KNO3溶液;④H2O;⑤CaCO3固体;⑥NaCl固体
A. ①②⑤ B. ②③⑥ C. ②③④⑤ D. ②④
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是( )
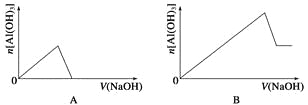
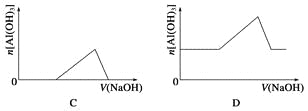
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组试剂在溶液中反应,当两种试剂的量发生改变时,不能用同一离子方程式表示的是
A. 氯化镁、氢氧化钠 B. 硫酸钠、氢氧化钡
C. 氯化铝、氨水 D. 溴化亚铁、氯水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
(1)利用H2 和CO在一定条件下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
①10min后达到平衡时CO的浓度为 ;
②10min内用H2表示的平均反应速率为 ;
③若要加快CH3OH的生成速率,可采取的措施有 (填一种合理的措施)
(2)利用H2 和CO2在一定条件下可以合成乙烯:6H2+2CO2![]() CH2=CH2+4H2O
CH2=CH2+4H2O
①已知:4.4gCO2与H2完全转化为CH2=CH2和水(气态)共放出6.39kJ的热量,
写出该反应的热化学方程式 。
②不同温度对CO2的转化率及催化剂的催化效率的影响如图甲所示。
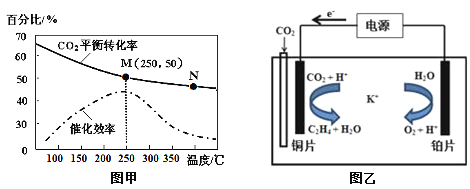
下列有关说法不正确的是 (填序号)。
A.不同条件下反应,N点的速率最大
B.温度在约250℃时,催化剂的催化效率最高
C.相同条件下,乙烯的产量M点比N高
③若在密闭容器中充入体积比为 3∶1的 H2和CO2,则图甲中M点时,产物CH2=CH2的体积分数为 。(保留两位有效数字)
(3)利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图乙所示。在阴极上产生乙烯的电极反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的作用,下列有关说法不正确的是( )
A.硅酸钠的水溶液俗称水玻璃,可用作木材防火剂
B.“地沟油”经过加工处理后,可以用来制肥皂
C.含磷污水是很好的肥料,可灌溉庄稼,可直接排放到自然界水体中
D.Fe2O3常用于生产红色油漆和涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温时,同种规格的铝片分别与下列物质混合,反应开始时生成氢气速率最大的是
A.0.1mol/L盐酸15ml
B.0.15mol/L硫酸8ml
C.0.2mol/L盐酸12ml
D.18mol/L硫酸15ml
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.胶体区别于其他分散系的根本原因是胶体有丁达尔现象
B.分散系中分散质粒子直径由小到大的正确顺序是:溶液<浊液<胶体
C.有单质参加或有单质生成的反应一定是氧化还原反应
D.失电子的反应物在反应中作还原化剂,反应中被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙烷燃料电池为电源进行电解的实验装置如图所示。下列说法正确的是
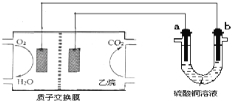
A.燃料电池工作时,正极反应为O2+2H2O+4e-═ 4OH-
B.a极是铜,b极是铁时,硫酸铜溶液浓度减小
C.a、b两极若是石墨,在同温同压下a极产生的气体与电池中消耗的乙烷体积的比为7/2
D.a极是纯铜,b极是粗铜时,a极上有铜析出,b极逐渐溶解,两极质量变化相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com