
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
(1)利用H2 和CO在一定条件下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
①10min后达到平衡时CO的浓度为 ;
②10min内用H2表示的平均反应速率为 ;
③若要加快CH3OH的生成速率,可采取的措施有 (填一种合理的措施)
(2)利用H2 和CO2在一定条件下可以合成乙烯:6H2+2CO2![]() CH2=CH2+4H2O
CH2=CH2+4H2O
①已知:4.4gCO2与H2完全转化为CH2=CH2和水(气态)共放出6.39kJ的热量,
写出该反应的热化学方程式 。
②不同温度对CO2的转化率及催化剂的催化效率的影响如图甲所示。
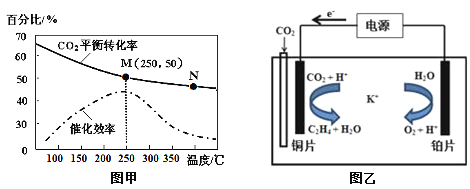
下列有关说法不正确的是 (填序号)。
A.不同条件下反应,N点的速率最大
B.温度在约250℃时,催化剂的催化效率最高
C.相同条件下,乙烯的产量M点比N高
③若在密闭容器中充入体积比为 3∶1的 H2和CO2,则图甲中M点时,产物CH2=CH2的体积分数为 。(保留两位有效数字)
(3)利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图乙所示。在阴极上产生乙烯的电极反应方程式为 。
【答案】(1)①0.4mol/L
②0.04mol/(L.min)
③增大压强(升高温度、使用催化剂等等合理均可)
(2)①6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)△H=-127.8 kJ/mol
CH2=CH2(g)+4H2O(g)△H=-127.8 kJ/mol
②a
③7.7% 或0.077
(3)2CO2+12H++12e﹣== CH2=CH2+4H2O
【解析】
试题分析:(1) CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度mol/L:0.6 0.5 0
转化浓度mol/L: 0.2 0.4 0.2
平衡浓度mol/L: 0.4 0.1 0.2
① 10min后达到平衡时CO的浓度为0.4mol/L;②10min内用H2表示的平均反应速率为:v=![]() =
=![]() =0.04mol/(L.min);③若要加快CH3OH的生成速率,可采取的措施有:增大压强(升高温度、使用催化剂等等)
=0.04mol/(L.min);③若要加快CH3OH的生成速率,可采取的措施有:增大压强(升高温度、使用催化剂等等)
(2)①4.4gCO2与H2完全转化为CH2=CH2和水(气态)共放出6.39kJ的热量,2mol二氧化碳放出127.8 kJ 的热量,则热化学方程式为:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)△H=-127.8 kJ/mol; ②a.N点的温度高,但是,催化剂的效率低,速率不一定最大,错误;b.根据图象,温度在约250℃时,催化剂的催化效率最高,正确;c.根据图象,当温度高于250℃,升高温度二氧化碳的平衡转化率减低,则平衡逆向移动,乙烯的产量M点比N高,正确;故选a;
CH2=CH2(g)+4H2O(g)△H=-127.8 kJ/mol; ②a.N点的温度高,但是,催化剂的效率低,速率不一定最大,错误;b.根据图象,温度在约250℃时,催化剂的催化效率最高,正确;c.根据图象,当温度高于250℃,升高温度二氧化碳的平衡转化率减低,则平衡逆向移动,乙烯的产量M点比N高,正确;故选a;
③设开始投料n(H2)为3mol,则n(CO2)为1mol,所以当在M点平衡时二氧化碳的转化率为50%,所以有6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)
CH2=CH2(g)+4H2O(g)
开始 3 1 0 0
转化 1.5 0.5 0.25 1
平衡 1.5 0.5 0.25 1
所以乙烯的体积分数为:0.25÷(1.5+0.5+0.25+1)×100%=7.7%;
(3)CO2在阴极上得电子生成乙烯,所以其电极反应方程式为:2CO2+12H++12e﹣== CH2=CH2+4H2O。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某同学设计实验从海带中提取碘
①滴加稀硫酸和双氧水
②在海带中加入少量酒精,点燃使其燃烧为灰烬,在灰烬中加水搅拌;
③加四氯化碳并振荡
④过滤
⑤分液。
该实验的合理操作顺序是
A. ①③⑤②④ B. ②①③④⑤ C. ②④①③⑤ D. ③①②⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在工农业生产中有着吸要的应用.
(l)已知:2SO2(g)+O2═2SO3(g)△H=-196.6kJmol-1,2NO(g)+O2═2NO2(g)△H=-113.0kJmol-1.则反应NO2(g)+SO2(g)═SO3(g)+NO(g)的△H= _________;
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料.已知As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O.当生成H3AsO4的物质的量为0.6mol,反应中转移电子的数目为_________。
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS-、S2-的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出),滴加过程中,溶液中微位浓度大小关系正确的是_________ (填字母)。
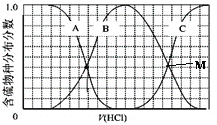
A.c(Na+)=c(H2S)+c(HS-)+2c(S2-)
B.2c(Na+)=c(H2S)+c(HS-)+c(S2-)
C.c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
(4)某学习小组以SO2为原料,采用电化学方法制取硫酸。该小组设计的原电池原理如图2所示.写出该电池负极的电极反应式_________;
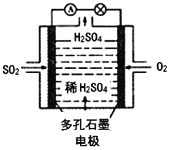
(5)难溶物ZnS遇CuSO4认溶液会慢慢转化为铜蓝(CuS)。若转化后溶液中c(Zn2+)=3.0×10-2molL-1,则c(Cu2+)= _________ molL-1〔已知Ksp(CuS)=1.0×10-36,Ksp(ZnS)=1.0×10-24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4溶液与K2C2O4溶液混合反应,产物之一是只含一种阴离子的蓝色钾盐水合物。通过下述实验确定该晶体的组成。
步骤a:称取0.6720 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 ml水加热,用0.2000 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 ml。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.2500 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 ml。
已知涉及的部分离子方程式为:
步骤a:2MnO4-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I-=2CuI↓+I2 I2+2S2O32-=2I-+S4O62-
(1)已知室温下CuI的Ksp=1. 27×10-12,欲使溶液中c(Cu+)≤1.0×10-6 mol·L-1,应保持溶液中c(I-)≥ mol·L-1。
(2)MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+。该反应的离子方程式为 。
若无该操作,则测定的Cu2+的含量将会 (填“偏高”、“偏低” 或“不变”)。
(3)步骤b用淀粉溶液做指示剂,则滴定终点观察到的现象为 。
(4)通过计算确定样品晶体的组成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X(盐)和Y(酸)反应,可放出有气味的气体Z,Z跟过量NaOH反应又得到X,Z氧化的最终产物为W气,W气溶于水又得到Y,则X和Y是
①Na2S和稀H2SO4②Na2SO3和盐酸
③Na2S和盐酸 ④Na2SO3和稀H2SO4
A. 只有① B. ①② C. ②③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸(CH2 = CH—COOH)的性质可能有
① 加成反应 ② 水解反应 ③ 酯化反应 ④ 中和反应 ⑤ 氧化反应 ⑥加聚反应
A.只有①③ B.只有①③④ C.只有①③④⑤⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的盐酸与过量的铁粉反应时,为了减缓反应速率且不影响生成氢气的总量,可向盐酸中加入适量的 ①NaOH固体;②Na2SO4溶液;③KNO3溶液;④H2O;⑤CaCO3固体;⑥NaCl固体
A. ①②⑤ B. ②③⑥ C. ②③④⑤ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)指出下列能量的变化:(每空1分)
学校燃烧煤煮饭 ,用畜电池点亮灯泡 。
(2)原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:
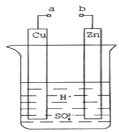
①a和b不连接时,烧杯中现象是 。
②a和b用导线连接,Cu极为原电池___极(填“正”或“负”),电极反应式为: ;溶液中H+移向_____(填“Cu”或“Zn”)极。电池总反应式为: 。
③若电解质溶液改为AgNO3溶液,当转移0.2mol电子时,则理论上Cu片质量变化为_ ___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化.在变化的各阶段被破坏的粒子间的主要相互作用依次是( )
A.氢键 分子间作用力 非极性键
B.氢键 极性键 分子间作用力
C.氢键 氢键 极性键
D.分子间作用力 氢键 非极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com