
【题目】(1)指出下列能量的变化:(每空1分)
学校燃烧煤煮饭 ,用畜电池点亮灯泡 。
(2)原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:
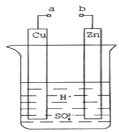
①a和b不连接时,烧杯中现象是 。
②a和b用导线连接,Cu极为原电池___极(填“正”或“负”),电极反应式为: ;溶液中H+移向_____(填“Cu”或“Zn”)极。电池总反应式为: 。
③若电解质溶液改为AgNO3溶液,当转移0.2mol电子时,则理论上Cu片质量变化为_ ___g。
【答案】(1) 化学能转化为热能 、电能转化为光能 (2) ① 锌片逐渐溶解,锌片上有气泡冒出
②正;2H++2e-=H2↑;Cu; ③Zn+H2SO4=ZnSO4+H2↑ ;21.6
【解析】
试题分析:(1)学校燃烧煤煮饭属于化学能转化为热能;用畜电池点亮灯泡属于电能转化为光能。
(2)①a和b不连接时,铜和稀硫酸不反应,锌与稀硫酸反应生成硫酸锌和氢气,则烧杯中现象是锌片逐渐溶解,锌片上有气泡冒出。
②a和b用导线连接后构成原电池,锌的金属性强于铜,则锌是负极,铜是正极,溶液中的氢离子在正极放电,则正极电极反应式为2H++2e-=H2↑;溶液中H+移向Cu极。电池总反应式为Zn+H2SO4=ZnSO4+H2↑。
③若电解质溶液改为AgNO3溶液,正极是溶液中的银离子放电,电极反应式为Ag++e-=Ag,当转移0.2mol电子时,正极析出0.2mol,因此理论上Cu片质量变化为0.2mol×108g/mol=21.6g。


科目:高中化学 来源: 题型:
【题目】下图是某研究性学习小组设计的对一种废旧合金各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。

已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是 。
(2)加入过量FeCl3溶液过程中与较活泼的金属反应的离子方程式: 。
(3)过量的还原剂应是 ,溶液b中所含的金属阳离子有 。
(4)① 向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为
② 若用X mol/LKMnO4溶液处理溶液b,当恰好反应时消耗KMnO4溶液Y mL,则最后所得红棕色固体C的质量为 g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为: > > 。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为m g,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为 L。(用含m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
(1)利用H2 和CO在一定条件下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
①10min后达到平衡时CO的浓度为 ;
②10min内用H2表示的平均反应速率为 ;
③若要加快CH3OH的生成速率,可采取的措施有 (填一种合理的措施)
(2)利用H2 和CO2在一定条件下可以合成乙烯:6H2+2CO2![]() CH2=CH2+4H2O
CH2=CH2+4H2O
①已知:4.4gCO2与H2完全转化为CH2=CH2和水(气态)共放出6.39kJ的热量,
写出该反应的热化学方程式 。
②不同温度对CO2的转化率及催化剂的催化效率的影响如图甲所示。
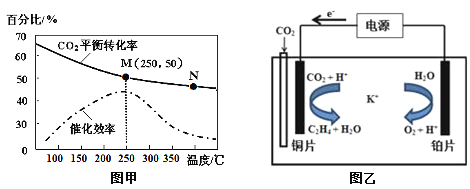
下列有关说法不正确的是 (填序号)。
A.不同条件下反应,N点的速率最大
B.温度在约250℃时,催化剂的催化效率最高
C.相同条件下,乙烯的产量M点比N高
③若在密闭容器中充入体积比为 3∶1的 H2和CO2,则图甲中M点时,产物CH2=CH2的体积分数为 。(保留两位有效数字)
(3)利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图乙所示。在阴极上产生乙烯的电极反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温时,同种规格的铝片分别与下列物质混合,反应开始时生成氢气速率最大的是
A.0.1mol/L盐酸15ml
B.0.15mol/L硫酸8ml
C.0.2mol/L盐酸12ml
D.18mol/L硫酸15ml
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.胶体区别于其他分散系的根本原因是胶体有丁达尔现象
B.分散系中分散质粒子直径由小到大的正确顺序是:溶液<浊液<胶体
C.有单质参加或有单质生成的反应一定是氧化还原反应
D.失电子的反应物在反应中作还原化剂,反应中被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)元素周期表分为 个横行,即 个周期,周期表中有 个纵行,共 个族。(每空1分)
(2)写出下列物质的电子式:①CO2 ;②NaOH 。(每空2分)
(3)下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:(离子方程式2分,其余每空1分)
主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
① 在这些元素中最活泼的非金属元素是 。
② 元素的最高价氧化物对应的水化物中酸性最强的是 ,碱性最强的是 。
③ 呈两性的氢氧化物是 ,其与③的最高价氧化物水化物反应的离子方程式为 。
④ 在③~⑦元素中,原子半径最大的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为_____________。
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如右图所示。

①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是__________。
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是_____________。
(3)纳米铁粉可用于处理地下水中的污染物。
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为 。
②纳米铁粉与水中NO3-反应的离子方程式为 4Fe+ NO3-+10H+=4Fe2++NH4++3H2O,研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是 。
③相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见右图),产生该差异的可能原因是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:

请同答下列问题:
(1)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度考虑,生产生石灰的主要原料来源于海洋中的________,其生产方程式___________。从离子反应的角度思考,往海水中加入石灰乳的作用是______________。
(2)操作A是____,操作B是______。
(3)加入的足量试剂a是_______(填化学式)。
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为___________,从考虑成本和废物循环利用的角度,副产物氯气可以用于____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com