
【题目】(1)元素周期表分为 个横行,即 个周期,周期表中有 个纵行,共 个族。(每空1分)
(2)写出下列物质的电子式:①CO2 ;②NaOH 。(每空2分)
(3)下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:(离子方程式2分,其余每空1分)
主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
① 在这些元素中最活泼的非金属元素是 。
② 元素的最高价氧化物对应的水化物中酸性最强的是 ,碱性最强的是 。
③ 呈两性的氢氧化物是 ,其与③的最高价氧化物水化物反应的离子方程式为 。
④ 在③~⑦元素中,原子半径最大的是 。
【答案】(1) 7,7, 18, 16 (2)![]()
![]()
(3) ① F ② HClO4KOH ③ Al(OH)3Al(OH)3+OH-=AlO2-+ H2O ④ Na
【解析】试题分析:(1)元素周期表分为7个横行,即7个周期,周期表中有18个纵行,共16个族,包括7个主族、7个副族、一个0族和第Ⅷ族。
(2)①CO2是共价化合物,电子式为![]() ;
;
②NaOH是含有离子键和共价键的离子化合物,电子式为![]() 。
。
(3)根据元素在周期表中的位置可知①~⑩中元素分别是N、F、Na、Mg、Al、Si、Cl、Ar、K、Br。
①同周期自左向右非金属性逐渐增强,同主族自上而下非金属性逐渐减弱,则在这些元素中最活泼的非金属元素是F。
②非金属性越强,最高价含氧酸的酸性越强,F没有含氧酸,则元素的最高价氧化物对应的水化物中酸性最强的是HClO4;金属性最强的是K,则碱性最强的是KOH。
③呈两性的氢氧化物是Al(OH)3,其与③的最高价氧化物水化物氢氧化钠反应的离子方程式为Al(OH)3+OH-=AlO2-+ H2O。
④同周期自左向右原子半径逐渐减小,则在③~⑦元素中,原子半径最大的是Na。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H22.8L(标准状况),原混合物质量可能是( )
A. 2g B. 4g C. 10g D. 12g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸(CH2 = CH—COOH)的性质可能有
① 加成反应 ② 水解反应 ③ 酯化反应 ④ 中和反应 ⑤ 氧化反应 ⑥加聚反应
A.只有①③ B.只有①③④ C.只有①③④⑤⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案。
方案一 滴定法:用酸性KMnO4溶液滴定,测定铁元素的含量
(1)写出该滴定反应的离子方程式 。
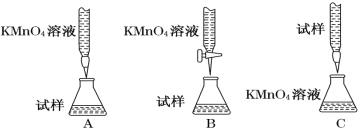
(2)某同学设计的下列滴定方式中,最合理的是________(夹持部分略去)(填字母序号)
(3)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、药匙、烧杯、胶头滴管外,还需 (填仪器名称)。
在溶液配制过程中,下列操作会导致配制结果偏低的是___________(填写代号)。
a. 定容时,俯视容量瓶刻度线
b. 容量瓶在使用前内有少量蒸馏水
c. 转移溶液后的烧杯、玻璃棒未洗涤
d. 定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(4)上述实验中KMnO4溶液需要酸化,用于酸化的酸是________。
a.浓盐酸 b.稀硫酸 c.稀硝酸 d.浓硫酸
方案二 称量法:操作流程如下:

(5)写出步骤②中H2O2氧化Fe2+ 的离子方程式______ __。
步骤②中除用H2O2外还可以使用的物质是
步骤②是否可以省略 ,理由是 。
(6)步骤④一系列操作依次是:过滤、洗涤、 、冷却、称量。
(7)假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)指出下列能量的变化:(每空1分)
学校燃烧煤煮饭 ,用畜电池点亮灯泡 。
(2)原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:
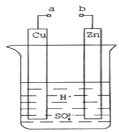
①a和b不连接时,烧杯中现象是 。
②a和b用导线连接,Cu极为原电池___极(填“正”或“负”),电极反应式为: ;溶液中H+移向_____(填“Cu”或“Zn”)极。电池总反应式为: 。
③若电解质溶液改为AgNO3溶液,当转移0.2mol电子时,则理论上Cu片质量变化为_ ___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理分析解答以下问题:
(1)弱酸在水溶液中存在电离平衡,部分0.1 mol·L-1弱酸的电离平衡常数如下表:
弱酸 | 电离平衡常数(25 ℃) |
HClO | K=2.98×10-8 |
H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 K2=1.02×10-7 |
①当弱酸的浓度一定时,降低温度,K值________(填“变大”“变小”或“不变”)。
②下列离子方程式和有关说法错误的是____________。
a.少量的CO2通入次氯酸钠溶液中:2ClO-+H2O+CO2===2HClO+CO32-
b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2CO32-===2HCO3-+SO32-
c.相同温度时,等物质的量浓度的三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为V(H2CO3)>V(H2SO3)>V(HClO)
d.相同温度时,等pH三种盐溶液的物质的量浓度关系:c(Na2CO3)<c(NaClO)<c(Na2SO3)
③亚硒酸(H2SeO3)也是一种二元弱酸,有较强的氧化性。往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式:___ 。
(2)工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统会产生很大损害,必须进行处理后方可排放。
①在废水中存在平衡:2CrO42- (黄色)+2H+![]() Cr2O72- (橙色)+H2O。若改变条件使上述平衡向逆反应方向移动,则下列说法正确的是_______。
Cr2O72- (橙色)+H2O。若改变条件使上述平衡向逆反应方向移动,则下列说法正确的是_______。
a.平衡常数K值可以不改变
b.达到新平衡CrO42-的消耗速率等于Cr2O72-的消耗速率
c.达到新平衡后,溶液pH一定增大
d.再达平衡前逆反应速率一定大于正反应速率
②Cr2O72-和CrO42-最终生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) ![]() Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的Ksp=10-32,当c(Cr3+)降至10-3 mol·L-1,溶液的pH调至4时,________(填“有”或“没有”)沉淀产生。
Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的Ksp=10-32,当c(Cr3+)降至10-3 mol·L-1,溶液的pH调至4时,________(填“有”或“没有”)沉淀产生。
(3)已知:①2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
②CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
③CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
某温度下三个反应的平衡常数的值依次为K1、K2、K3,则该温度下反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)的化学平衡常数K=________(用含K1、K2、K3的代数式表示)。向某固定体积的密闭容器中加入3 mol CO和3 mol H2,充分反应后恢复至原温度,测定容器的压强为反应前的1/2,则CO的转化率为_________。
CH3OCH3(g)+CO2(g)的化学平衡常数K=________(用含K1、K2、K3的代数式表示)。向某固定体积的密闭容器中加入3 mol CO和3 mol H2,充分反应后恢复至原温度,测定容器的压强为反应前的1/2,则CO的转化率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)===2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1
③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1
下列有关反应速率的比较中正确的是
A.①>②>③>④ B.④<③=②<① C.④>③=②>① D.④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备纳米颗粒Y(化合物)的反应为:
3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O。下列说法中,不正确的是
A.S2O32-是还原剂
B.Y的化学式为Fe2O3
C.a=4
D.每有1 mol O2参加反应,转移的电子总数为4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)在仪器a 分液漏斗 b 试剂瓶 c 集气瓶 d 滴定管 e 容量瓶f 量筒 g 托盘天平中,标有“0”刻度的是________(填序号,有2个选项)。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺,在下列仪器中,没有用到“磨砂”工艺处理的有________(填序号,有2个选项)。
a.试管
b.分液漏斗
c.带滴管的试剂瓶(滴瓶)
d.碱式滴定管
e.酸式滴定管
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体,可供选择的液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液。试回答下列问题:
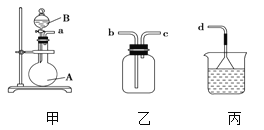
① 若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为________,制取该气体利用了B的性质有________、_____ 。
通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为________。
②若在乙中收集氨气,气体流经装置的顺序是:a→____→_____→d(填接口代号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com