
����Ŀ������Ŀ�ṩ���ܶȻ����ݽ��м��㲢�ش�����������
��1����Ca(NO3)2��Һ�м���(NH4)2CO3��Һ�����,�������Һ��c(CO32-)=10-3mol��L-1,��Ca2+�Ƿ������ȫ?________(����������������)��[��֪c(Ca2+)��10-5mol��L-1ʱ����Ϊ������ȫ��Ksp(CaCO3)=4.96��10-9]
��2����֪25��ʱ��Ksp[Mg(OH)2]��4.0��10-12�����ָʾ�����������ɫ��pH��Χ���£�
pH | ��8.0 | 8.0��9.6 | ��9.6 |
��ɫ | ��ɫ | ��ɫ | ��ɫ |
25��ʱ����Mg(OH)2������Һ�еμ�2�ΰ������ָʾ������Һ����ɫΪ___________��
��3����50 mL 0.018 mol��L-1��AgNO3��Һ�м���50 mL 0.020 mol��L-1�����ᣬ���ɳ�������֪���¶���AgCl��Ksp��1.0��10-10��������Һ������仯������㣺
����ȫ��������Һ��c(Ag+)��__________ mol��L-1��
����ȫ��������Һ��pH��__________��
��4�� ��֪������Ksp[Fe��OH��3]=1��10-39��ijCuSO4��Һ�к���Fe3+,���Լ���_________������Һ��pH=___________ʹ��Һ�е�c��Fe3+��=10-5 mol/L��ȥ
���𰸡�����ɫ1.0��10 �� 7 mol��L �� 12CuO ����������ͭ��ʽ̼��ͭ�ȶ�����2.7
��������
(1)����Ksp(CaCO3)��c(Ca2+)��c(CO32-)��4.96��10-9����c(Ca2+)��![]() mol��L-1��4.96��10-6mol��L-1<10-5mol��L-1������Ϊ������ȫ��
mol��L-1��4.96��10-6mol��L-1<10-5mol��L-1������Ϊ������ȫ��
�ʴ�Ϊ���ǣ�
(2)��Mg(OH)2������Һ��c(OH-)Ϊxmol��L-1����0.5x3��4.0��10-12��x=2.0��10-4��c(H+)=5.0��10-11mol��L-1��pH=11-lg5=10.3>9.6����ҺΪ��ɫ��
�ʴ�Ϊ����ɫ��
(3)�ٷ�Ӧǰ��n(Ag+)��0.018 mol��L-1��0.05 L��0.9��10-3mol��n(Cl-)��0.020 mol��L-1��0.05 L��1��10-3mol����Ӧ��ʣ���Cl-Ϊ0.1��10-3mol��������Һ�У�c(Cl-)��1.0��10-3mol��L-1��c(Ag+)��Ksp(AgCl)/c(Cl-)��![]() =1.0��10-7mol��L-1��
=1.0��10-7mol��L-1��
��H+û�в��뷴Ӧ����ȫ������c(H+)��0.020 mol��L-1��![]() =0.010 mol��L-1��pH��2��
=0.010 mol��L-1��pH��2��
�ʴ�Ϊ��1.0��10 �� 7 mol��L �� 1 ��2��
(4) ����Ksp[Fe��OH��3]= c(Fe3+)��c3(OH-)��1��10-39����ʹ��Һ�е�c��Fe3+��=10-5 mol/L����c3(OH-)=![]() =1��10-34��c(OH-)=10-11.3mol/L����c(H+)=10-2.7mol/L��pH=2.7��Ϊ�˲��������ʿɼ���CuO ��������ͭ���ʽ̼��ͭ�ȵ�����Һ��pH��
=1��10-34��c(OH-)=10-11.3mol/L����c(H+)=10-2.7mol/L��pH=2.7��Ϊ�˲��������ʿɼ���CuO ��������ͭ���ʽ̼��ͭ�ȵ�����Һ��pH��
�ʴ�Ϊ��CuO ����������ͭ��ʽ̼��ͭ�ȶ�������2.7��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ2A��g����B��g��![]() 2C��g��������Ӧ���ȣ�������ͼ����ȷ����
2C��g��������Ӧ���ȣ�������ͼ����ȷ����
A.  B.
B.  C.
C.  D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ζ���һ����Ҫ�Ķ���ʵ�鷽����
��.����к͵ζ�:������,��0.1000mol/L NaOH��Һ�ֱ�ζ�20.00mL ��Ũ�ȵ�����ʹ�����Һ,�õ������ζ�����,����ͼ��ʾ��
��1���ζ������������ͼ__________������1������2����
��2���ζ�ǰCH3COOH�ĵ����Ϊ__________
��3���ﵽB��D״̬ʱ,��Ӧ���ĵ�NaOH��Һ�����a__________b������>����<������=����
��.������ԭ�ζ�ԭ�����к͵ζ�ԭ������,Ϊ�˲ⶨijNaHSO3����Ĵ���,����0.1000mol/L������KMnO4��Һ���еζ�,�ش���������:
��1��ȷ��ȡһ�����������KMnO4��Һ��Ҫʹ�õ�������___________________��
��2����֪����KMnO4��Һ�Ļ�ԭ����ΪMnSO4,д���˷�Ӧ�����ӷ���ʽ:_____
��3����ȷ��ȡWgNaHSO3��������ˮ���500mL��Һ,ȡ25.00mL������ƿ��,��KMnO4��Һ�ζ����յ�,����KMnO4��ҺVmL����ζ��յ������Ϊ_______NaHSO3����Ĵ���Ϊ_________��
��4�����в����ᵼ�²ⶨ���ƫ�͵���__________.
A δ�ñ�Ũ�ȵ�����KMnO4��Һ��ϴ�ζ���
B �ζ�ǰ��ƿδ����
C ʢװ����KMnO4��Һ�ĵζ��ܣ��ζ�ǰ�ζ��ܼ��첿��������, �ζ���������
D ��С�Ľ���������KMnO4��Һ������ƿ��
E �۲����ʱ,�ζ�ǰ����,�ζ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д������������ˮ��Һ�еĵ��뷽��ʽ:�Ȼ�ͭ_______________��������____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�������õIJ��ֹ�����ͼ��ʾ������˵���������

A. ���±��ͨ��Cl2��Ϊ����ȡ��
B. ���οɲ��ó��Ӻ��ؽᾧ�ȹ����ᴿ
C. ��ҵ�����г�ѡ��NaOH��Ϊ������
D. ������һ�����ÿ�����ˮ�������������壬����SO2���仹ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µĶ��������У���������Щ���������ٷ����仯ʱ��������ӦA(s)��2B(g)![]() C(g)��D(g)�Ѵﵽƽ��״̬�� ��
C(g)��D(g)�Ѵﵽƽ��״̬�� ��
�ٻ�������ѹǿ �ڻ��������ܶ� �� B�����ʵ���Ũ�� �ܻ������������ʵ��� �ݻ�������ƽ����Է������� ��v(C)��v(D)�ı�ֵ �������������� ��C��D�ķ�����֮��Ϊ1��1
A. �ڢۢܢ� B. �٢ۢݢ� C. �ڢۢݢ� D. �ڢۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ŀ����֪����H2(g)+ ![]() O2(g)=2H2O(g) ��H1=akJ/mol
O2(g)=2H2O(g) ��H1=akJ/mol
��2H2(g)+O2(g)=2H2O(g) ��H2=b kJ/mol
��H2(g)+ ![]() O2(g)=H2O(l) ��H3=ckJ/mol��
O2(g)=H2O(l) ��H3=ckJ/mol��
��2H2(g)+O2(g)=2H2O(l) ��H4=dkJ/mol��
���й�ϵ��ȷ����
A. a<c<0 B. b>d>0 C. 2a=b<0 D. 2c=d>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ȼ�ѧ����ʽ�ó��Ľ�����ȷ����
A. ��2H2��g����O2��g����2H2O��g����H��-483��6kJ��mol��1����H2ȼ����Ϊ241��8kJ��mol��1
B. ��C��ʯī��s����C�����ʯ��s����H>0����ʯī�Ƚ��ʯ�ȶ�
C. ��֪NaOH��aq����HCl��aq����NaCl��aq����H2O��l����H��-57��4kJ��mol��1����20��0gNaOH������ϡ������ȫ�кͣ��ų�28��7kJ������
D. ��֪2C��s����2O2��g����2CO2��g����H1��2C��s����O2��g����2CO��g����H2������H1>��H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ܶ����嶼����������Ȫʵ�飬����ͬ��ͬѹ�������������ƿ��һ���ռ���![]() ��
��![]() �Ļ�����壬��һ���ռ���
�Ļ�����壬��һ���ռ���![]() ����ͼ��ʾ����Ȫʵ��ֹͣ��������ƿ����Һ�����ʵ����ʵ���Ũ�ȣ�
����ͼ��ʾ����Ȫʵ��ֹͣ��������ƿ����Һ�����ʵ����ʵ���Ũ�ȣ�![]() �������ʵ�����������
�������ʵ�����������![]() ����ϵ�ǣ�����ƿ������Һ�ܶȼ�����ȣ�
����ϵ�ǣ�����ƿ������Һ�ܶȼ�����ȣ�
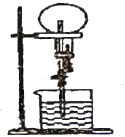
A. ![]() ��
��![]() ����ͬ B.
����ͬ B. ![]() ��
��![]() ����ͬ
����ͬ
C. ![]() ��ͬ��
��ͬ��![]() ��ͬ D.
��ͬ D. ![]() ��ͬ��
��ͬ��![]() ��ͬ
��ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com