
【题目】写出下列物质在水溶液中的电离方程式:氯化铜_______________;硫酸铁____________。
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。下列说法错误的是
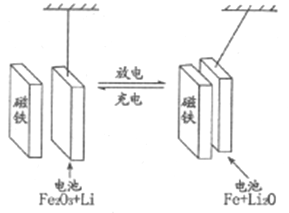
A. 放电时,负极的电极反应式为Li-e-=Li+
B. 放电时,电子通过电解质从Li流向Fe2O3
C. 充电时,Fe做阳极,电池逐渐摆脱磁铁吸引
D. 充电时,阳极的电极反应式为2Fe+3Li2O-6e-= Fe2O3+6Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置:
ⅠA | 0 | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ |
请按要求回答下列问题。
(1)元素④的名称是______
(2)元素⑦的原子结构示意图是____________。
(3)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:________(写氢化物的化学式)。
(
(5)元素⑤的单质在氧气中燃烧所得产物中化学键的类型为_____________________
(6)用电子式表示①与⑨反应得到的化合物的形成过程_______________。
(7)两种均由①④⑤⑦四种元素组成的化合物,在水溶液中发生反应的离子反应方程式为________
(8)第三周期元素Na Mg Al S Cl 的简单离子半径由大到小的顺序是______(用离子符号表示)
(9)已知1g①的单质燃烧生成液态产物时放出142.9kJ的热量,写出表示该单质燃烧热的热化学方程式:____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃的1个分子中含有9个碳原子,其一氯代物只有两种,该烷烃的名称是( )
A.正壬烷B.2,6-二甲基庚烷
C.2,2,4,4-四甲基戊烷D.2,3,4-三甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据题目提供的溶度积数据进行计算并回答下列问题:
(1)在Ca(NO3)2溶液中加入(NH4)2CO3溶液后过滤,若测得滤液中c(CO32-)=10-3mol·L-1,则Ca2+是否沉淀完全?________(填“是”或“否”)。[已知c(Ca2+)≤10-5mol·L-1时可视为沉淀完全,Ksp(CaCO3)=4.96×10-9]
(2)已知25℃时,Ksp[Mg(OH)2]=4.0×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
pH | <8.0 | 8.0~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为___________。
(3)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=__________ mol·L-1。
②完全沉淀后,溶液的pH=__________。
(4) 已知常温下Ksp[Fe(OH)3]=1×10-39,某CuSO4溶液中含有Fe3+,可以加入_________调节溶液的pH=___________使溶液中的c(Fe3+)=10-5 mol/L除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的1/4,C的原子半径在所有短周期主族元素中最大,甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005 mol/L戊溶液的pH=2,它们之间的转化关系如图所示(部分反应物省略),下列叙述一定正确的是
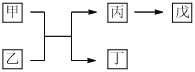
A. C、D两元素形成的化合物的原子个数比为1:2
B. C、E形成的化合物的水溶液呈碱性
C. 简单离子半径:D> C> B
D. 最高价氧化物对应水化物的酸性:E>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法中正确的是
为阿伏加德罗常数的值,下列说法中正确的是
A. 常温常压下,![]()
![]() 中含有极性共价键的数目为
中含有极性共价键的数目为![]()
B. ![]()
![]() 硫酸与足量铜反应,生成
硫酸与足量铜反应,生成![]() 的分子数为
的分子数为![]()
C. 等体积、等物质的量浓度的![]() 和
和![]() 溶液中,阴、阳离子数目之和均约为
溶液中,阴、阳离子数目之和均约为![]()
D. ![]()
![]() 晶体中阳离子和阴离子的总数为
晶体中阳离子和阴离子的总数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com