
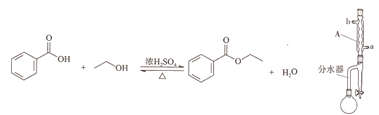
����Ŀ��ʵ�����Ʊ������������ķ�Ӧװ��ʾ��ͼ���й��������£�
��Է������� | �ܶ�/(g/cm3) | �е�/�� | ˮ���ܽ��� | |
������ | 122 | 1.266 | 249 | �� |
�Ҵ� | 46 | 0.789 | 78.3 | �� |
���������� | 150 | 1.045 | 213 | ���� |
������ | 84 | 0.779 | 80.8 | ���� |
�����顢�Ҵ���ˮ���γɹ�����,������е�Ϊ62.1�档
�ϳɷ�Ӧ:��Բ����ƿ�м���6.1g�����ᡢ20mL��ˮ�Ҵ���25mL�������2Ƭ���Ƭ,������ټ���2mLŨ���ᡣ��ͼ��װ��������,ˮԣ���Ȼ���1.5Сʱ��
�����ᴿ:����ˮԡ�������������Ҵ��ͻ�����,����ˮ���ų���ʣ�����ʵ���ʢ��60mL��ˮ���ջ��У�������̼���ơ���ˮ�Ȼ��ƴ�����,���������ռ�210��213�����֡��ò�Ʒ5.0g��
�ش���������:
��1������A������Ϊ_______����ȴˮӦ��______(�a����b��)��������
��2�����뻷�����Ŀ��Ϊ______________��
��3���ϳɷ�Ӧ��,��ˮ���л���ֲַ�����,���²�Һ�������࣬���²�Һ��߶ȳ������ˮ��֧��Լ2cmʱ���������ų������²㲨�塣�ò�����Ŀ��Ϊ_________________��
��4��ʵ���м���̼���Ƶ�Ŀ��Ϊ__________����̼���ƴ�����,���ֲ�Ʒ��ˮ�ֲ㲻��,�ɲ�ȡ�Ĵ�ʩΪ___________(����ĸ)��
��5���ڸ�ʵ���У�Բ����ƿ���ݻ����ʺϵ���_____��
A��50mL B��100mL C��200mL D��300mL
��6����ʵ��IJ���Ϊ______________��
���𰸡� ���������� b �ڽϵ��¶��³�ȥ����ˮ����߲��� ȷ���Ҵ��ͻ����鼰ʱ���ط�Ӧ��ϵ���²�ˮ�����������ϵ�� �кͱ���������� ���Ȼ��ƽ������� B 66.7%
����������1���������Ľṹ��������֪AΪ���������ܣ��ڱ�ʵ���������ܵ����ý���������ΪҺ�壬ˮ������Ӧ����Ч�����ã���������ˮӦ��b��������
�ʴ�Ϊ�����������ܣ�b��
��2��������֪��Ϣ�������顢�Ҵ���ˮ���γɹ�����,������е�Ϊ62.1�桱�����Ի������ںϳɷ�Ӧ�е�����Ϊ�ڽϵ��¶��´������ɵ�ˮ���ٽ�������Ӧ���ҽ��У���߲��ʡ�
�ʴ�Ϊ���ڽϵ��¶��³�ȥ����ˮ����߲��ʣ�
��3����ˮ�����ϲ�����״��²���ˮ�����Ͳ�Һ�����֧�ܿ�ʱ���Ͳ������֧��������ƿ�����ﵽ�˷�Ӧ��������������߲��ʵ�Ŀ�ġ����²�Һ��߶ȳ������ˮ��֧��Լ2cmʱ��Ӧ�����������ų�ˮ������ˮ������������ƿ��
�ʴ�Ϊ��ȷ���Ҵ��ͻ����鼰ʱ���ط�Ӧ��ϵ���²�ˮ�����������ϵ�У�
��4���ϳɷ�Ӧ��������ƿ����Ҫ�б���������������������ᣨδ��Ӧ�꣩�����ᣨ���������Ҵ��������飬ˮԡ���ȳ�ȥ�Ҵ��ͻ����飬ʣ���������ҪΪ�����������������ᡢ���ᡣ����̼���ƿ��кͱ����ᡢ���ᣬ���������ڵ��Σ���Һ�ֲ㡣��̼���ƴ�����,���ֲ�Ʒ��ˮ�ֲ㲻�壬�ɼ���ʳ�Σ���һ�����������ܽ⣬��Ϊ������Ȼ���÷�Һ©���ֳ��л��㣬������ˮ�Ȼ������ղ��ֵ�ˮ���ٽ���������210��213�����֡�
�ʴ�Ϊ���кͱ������������Ȼ��ƽ���������
��5������Բ����ƿ��6.1g�����ᣬ���ݱ����е��ܶȿɹ��Ʊ�����ԼΪ5mL������Բ����ƿ����Һ�����ԼΪ��5+20+25+2��=52mL������ƿ����ʢ�ŵ���Һ�������������ƿ��2/3������ѡ��100mL����ƿ����ѡB��
��6��m(�Ҵ�)= 0.789g/mL��20mL=15.78g��m(������)=6.1g �������۲���Ϊx�����У�
122g 46g 150g
6.1g 15.78g�������� x
����122g��150g=6.1g��x�����x=7.5g��
����=![]() ��
��
�ʴ�Ϊ��66.7%



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֳ������ʵ�ת����ϵ��ͼ��ʾ(���ַ�Ӧ�P������ȥ),����Q��M��N����ij����ͬ��Ԫ�ء�����˵������ȷ����
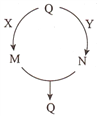
A. ��QΪN2����X����Ϊ���� B. ��QΪA1(OH)3����Y����Ϊϡ����
C. ��QΪFe,��Y����Ϊϡ���� D. ��QΪNaHCO3����X����Ϊ����������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E���ֶ�����Ԫ�أ���֪���ڵ�A��B��C��D����Ԫ��ԭ�Ӻ����56�����ӣ������ڱ��е�λ����ͼ��ʾ��E�ĵ��ʿ����ᷴӦ��1molE���������������ã��ڱ�״�����ܲ���33.6LH2��E����������A�������Ӻ�����Ӳ�ṹ��ȫ��ͬ�� 
�ش��������⣺
��1��B��Ԫ������Ϊ �� D�����ڱ��е�λ�� ��
��2��A��C��D��Ӧ�����Ӱ뾶�ɴ�С˳��Ϊ �� ���û�ѧ���ű�ʾ��
��3��D�ĵ�����ˮ��Ӧ�����ӷ���ʽΪ ��
��4����D��E�γɵĻ������ˮ��Һ�е�������ռ���Һ�������ӷ���ʽ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӧ�û���ʵ�뽺�������û�й�ϵ���ǣ� ��
A. ��������������ˮ
B. ��ʯ�����±���ƶ���
C. ��CuSO4��Һ����μ����ռ���Һ������ɫ����
D. ���ֵ�Ͳ����ҹ���л����һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ�ý���ʵ�飬��Һ��A��μ��뵽����B�У�����������ȷ����
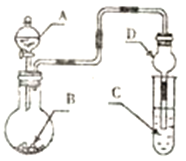
A. ��AΪŨ���ᣬBΪMnO2��C��ʢ��I2������Һ��C����Һ����ɫ
B. ��AΪH2O2��BΪMnO2��C��ʢ��Na2S��Һ��C����Һ�����
C. ��AΪŨ��ˮ��BΪ��ʯ�ң�C��ʢ��AlCl3��Һ��C���Ȳ�����ɫ������������ܽ�
D. ��AΪŨH2SO4��BΪCaCO3��C��ʢ��Na2SiO3��Һ��C����Һ���ְ�ɫ������֤���ǽ�����S>C>Si
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪: A��B��C��D��E��F��G ��ԭ��������������Ķ���������Ԫ�أ�A��ԭ�Ӻ��������ӣ�B��F ��Ԫ�����ڱ��е����λ����ͼ��B ��D ���γ�������ɫ���壬D �ǵؿ��к�������Ԫ�أ�E�ǵؿ��к������Ľ���Ԫ����

��ش���������:
��1��BF2 �ĽṹʽΪ:_____________��
��2��D��F�ļ��⻯���зе�ϸߵ���:________��(�ѧʽ)
��3��ʵ������ȡG2��������ӷ���ʽΪ:____________________��
��4�������ӹ�ҵ�У�C �������̬�ջ����ˮ��Һ������ʴ��H2O2 �����������������Ӧ�IJ��� ����Ⱦ�������仯ѧ����ʽΪ:___________________��
��5��FD2 ����ͨ��BaCl2 ��C������������Ӧ��ˮ����Ļ����Һ�У����ɰ�ɫ��������ɫ���壬 �йط�Ӧ�����ӷ���ʽΪ_____________________��
��6�����ʹ��B2A8C2 ��ȼ�ϣ�N2O4Ϊ��������ȼ�շų��ľ������ܰѻ������̫�գ����Ҳ������� ����Ⱦ�����壬�仯ѧ����ʽΪ:_________________��
��7������Ԫ���������Q: CA4E(FD4)2����ʢ��20 mL 0.5 mol/L Q��Һ���ձ��м���12 mL2.0 mo/LBa(OH)2��Һ����ַ�Ӧ����Һ�в������������ʵ���Ϊ:__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤������������˵���У���ȷ���ǣ� ��
A.1.8g��ˮ��D2O���к��е�������Ϊ1.0 NA
B.500�桢30MPa�£�N2��g��+3H2��g��2NH3��g������H=��38.6kJmol��1����1.5NA��H2����N2�ڴ������³�ַ�Ӧ���ų�����19.3kJ
C.��״���£�11.2 L Cl2ͨ��������ʯ�������Ʊ�Ư�ۣ�ת�Ƶĵ�����Ϊ0.5NA
D.60 gʯӢ�����к��е�Si��O����ĿΪ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D����Ԫ����Ԫ�����ڱ��е�λ�ù�ϵ���ұ���ʾ��
��1��A������⻯��Ļ�ѧʽΪ_________
��2��B��ԭ�ӽṹʾ��ͼΪ__________
��3��C ��ԭ������Ϊ_________
��4��D�ĵ�����KI��Ӧ�����ӷ���ʽΪ___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һλͬѧΪ̽��Ԫ�����ڱ���Ԫ�����ʵĵݱ���ɣ������������ʵ�飮
������1�����ơ��ء�þ������1mol�ֱ�Ͷ�뵽������ͬŨ�ȵ������У���Ԥ��ʵ������ �����ᷴӦ����ң� �����ᷴӦ���ٶ������� �����ᷴӦ������������࣮
��2����Na2S��Һ��ͨ���������ֻ�ɫ���ǣ���֤��Cl�ķǽ����Ա�Sǿ����Ӧ�����ӷ���ʽΪ
����������ͼװ�ÿ���֤ͬ����Ԫ�طǽ����Եı仯���ɣ�
��3������B������Ϊ �������D������Ϊ ��
��4����Ҫ֤���ǽ����ԣ�Cl��I����A�м�Ũ���ᣬB�м�KMnO4��KMnO4��Ũ���᳣���·�Ӧ������������C�мӵ��۵⻯�ػ����Һ���۲쵽C����Һ ��������֤�����ӻ��������Ĺ۵㿼�ǣ���װ��ȱ��β������װ�ã����� ��Һ����β����
��5����Ҫ֤���ǽ����ԣ�C��Si������A�м����ᡢB�м�CaCO3��C�м�Na2SiO3��Һ���۲쵽C����Һ ��������֤�������е�ͬѧ��Ϊ������лӷ��ԣ��ɽ���C�и���ʵ�飬Ӧ����װ�ü�����װ�� ��Һ��ϴ��ƿ��ȥ��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com