
【题目】碳、氮元素是构成生物体的主要元素,在动植物生命活动中起着重要作用。根据要求回答下列问题:
(1)氮原子核外有___________种不同运动状态的电子,基态氮原子核外电子排布图为___________。
(2)已知:(NH4)2CO3![]() 2NH3↑+H2O↑+CO2↑
2NH3↑+H2O↑+CO2↑
①与氧同周期,且第一电离能比氧大的元素有___________种。
②分解所得的气态化合物分子的键角由小到大的顺序为___________(填化学式)。
(3)物质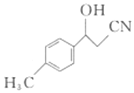 中与CO32-中的碳原子杂化类型相同和不同的碳原子的个数比为___________。
中与CO32-中的碳原子杂化类型相同和不同的碳原子的个数比为___________。
(4)配合物[Cu(CH3C≡N)4]BF4中铜原子的价电子排布式:___________,BF4-的空间构型为___________。写出与BF4-互为等电子体的一种分子和一种离子的化学式:___________、___________。
(5)碳元素与氮元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4个碳原子位于立方体的面心,4个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。
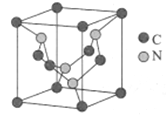
①晶胞中C原子的配位数为___________。该晶体硬度超过金刚石的原因是___________。
②已知该晶胞的边长apm,阿伏加德罗常数用NA表示,则该晶体的密度为___________。
【答案】7 ![]() 3 H2O<NH3<CO2 3:2 3d104s1 正四面体 CCl4 SO42- 4 该晶体和金刚石均为原子晶体,该晶体中的C-N键的键长比金刚石中的C-C键的键长短,键能大,故硬度大
3 H2O<NH3<CO2 3:2 3d104s1 正四面体 CCl4 SO42- 4 该晶体和金刚石均为原子晶体,该晶体中的C-N键的键长比金刚石中的C-C键的键长短,键能大,故硬度大 ![]()
【解析】
(1)原子核外没有运动状态相同的电子;N原子价电子排布式是为2s22p3,结合泡利原理、洪特规则画出价电子排布图;(2)①与氧同周期,且第一电离能比氧大的元素有N、F、Ne;②分解所得的气态化合物有H2O、NH3、CO2,H2O为V形,NH3为三角锥形,CO2为直线形,H2O中有两对孤电子对,NH3中1对孤电子对,孤电子对与键合电子对斥力大于键合电子对与键合电子对间斥力;(3)CO32-中C的杂化方式为sp2,分子中苯环C为sp2杂化,-CN中C为sp杂化,-CH3与-CH2-中与-CH中C为sp3杂化,据此计算;
(4)判断空间构型时可利用价层电子对互斥理论。BF4-中无孤电子对,有4个σ键电子对,故呈四面体形;寻找等电子体时可利用价电子迁移法找到;(5)①根据晶胞结构分析,1个C周围等距且最近的N有4个,晶体硬度超过金刚石,从C-N的键能和C-C键能角度分析;②先计算晶胞的质量和体积,再计算晶体的密度。
(1)原子核外没有运动状态相同的电子,基态氮原子核外有7个电子,有7种不同的运动状态;N原子核外电子排布式是1s22s22p3,结合泡利原理、洪特规则,其核外电子排布图为![]() ;
;
(2)①与氧同周期,且第一电离能比氧大的元素有N、F、Ne,共有3种;②解所得的气态化合物有H2O、NH3、CO2,H2O为V形,NH3为三角锥形,CO2为直线形,H2O中有两对孤电子对,NH3中1对孤电子对,孤电子对与键合电子对斥力大于键合电子对与键合电子对间斥力,所以键角大小为:H2O<NH3<CO2;(3)CO32-中C的杂化方式为sp2,分子中苯环C为sp2杂化,-CN中C为sp杂化,-CH3与-CH2-与-CH中C为sp3杂化,所以分子中sp2杂化C有6个,sp杂化C有1个,sp3杂化C有3个,所以与CO32- 的碳原子杂化类型相同和不同的碳原子的个数比为6:4=3:2;(4)Cu为29号元素,基态原子的核外电子排布式为[Ar]3d104s1,故基态原子的价层电子排布式为3d104s1;BF4-中心原子B的价层电子对数为4+![]() =4,杂化方式为sp3,则空间构型为正四面体形;BF4-共有5个原子,价电子总数为32,结合等电子体理论可知CCl4、PO43-、SO42-和ClO4-均与之为等电子体;(5)①根据晶胞结构分析,1个C周围等距且最近的N有4个,晶体硬度超过金刚石,从C-N的键能和C-C键能角度分析,该晶体和金刚石二者均为原子晶体,该晶体中的C-N键的键长比金刚石中的C-C键的键长短,键能大,故硬度较金刚石大;②该晶胞中含有碳原子数为8×
=4,杂化方式为sp3,则空间构型为正四面体形;BF4-共有5个原子,价电子总数为32,结合等电子体理论可知CCl4、PO43-、SO42-和ClO4-均与之为等电子体;(5)①根据晶胞结构分析,1个C周围等距且最近的N有4个,晶体硬度超过金刚石,从C-N的键能和C-C键能角度分析,该晶体和金刚石二者均为原子晶体,该晶体中的C-N键的键长比金刚石中的C-C键的键长短,键能大,故硬度较金刚石大;②该晶胞中含有碳原子数为8×![]() +6×
+6×![]() =3,含有N原子数目为4,则晶胞的化学式为C3N4,一个晶胞的质量为
=3,含有N原子数目为4,则晶胞的化学式为C3N4,一个晶胞的质量为![]() g,晶体的体积为(a×10-10)3cm3,故晶胞的密度为
g,晶体的体积为(a×10-10)3cm3,故晶胞的密度为![]() =
=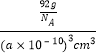 =
=![]() g/cm3.
g/cm3.


科目:高中化学 来源: 题型:
【题目】MOH强碱溶液和等体积、等浓度的HA弱酸溶液混合后,溶液中有关离子的浓度应满足的关系是( )。
A.c(M+)>c(OH-)>c(A-)>c(H+)B.c(M+)>c(A-)>c(H+)>c(OH-)
C.c(M+)>c(A-)>c(OH-)>c(H+)D.c(M+)>c(H+)>c(A-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿是冶炼金属铝的重要原料,其中主要成分为 Al2O3、Fe2O3 等。工业上可 NaOH 溶解 Al2O3 使 其与杂质分离:Al2O3+2NaOH═2NaAlO2+H2O
(1)找出上述反应中化合价为负值的元素,写出其原子的电子式_____。
(2)同温同压下,上述元素形成的气体密度最大的物质的分子式为_____。
(3)上述反应中两种金属元素对应单质的活泼性强弱关系为:____,从原子结构的角度分 析其原因:_________。
(4)若根据化学性质进行物质分类,则 Al2O3 属于______氧化物,据此推测下列反应方程式正确的是______。
A.Al2O3+3H2O═2Al(OH)3
B.2Al(OH)3+3H2SO4═Al2(SO4)3+3H2O
C.Al(OH)3+NaOH═NaA1O2+2H2O
D NaAlO2+4HCl═AlCl3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建国70周年阅兵式上,飞机拉烟原理是吊舱中的彩烟剂被加压N2吹出,送入高温尾气中,尾气中的蒸汽遇冷凝结成雾,形成“彩烟”。下列有关说法正确的是( )
A.彩烟是一种纯净物
B.蒸汽凝结为雾发生了化学变化
C.蒸汽遇冷形成的雾是一种分散系
D.拉烟原理与焰色试验的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1L0.2mol/LKMnO4酸性溶液与一定量pH=3的草酸(HOOC-COOH)溶液混合,放出VL气体。NA代表阿伏加德罗常数的值,下列说法正确的是
A. pH=3的草酸溶液含有H+数目为0.001NA
B. 当1molKMnO4被还原时强酸提供H+数目为NA
C. 1molHOOC-COOH含共用电子对数目为9NA
D. 该反应释放CO2分子数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g) +H2O(g) ![]() CO2(g) +H2 (g) △H<0,t℃时物质浓度(mol·L-1)的变化CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=_________mol·L-1·min-1。
CO2(g) +H2 (g) △H<0,t℃时物质浓度(mol·L-1)的变化CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=_________mol·L-1·min-1。
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c4 |
4 | c1 | c2 | c3 | c4 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |

(2)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min~4min之间反应处于_________状态; c 1数值_________0.08 mol·L-1 (填大于、小于或等于)
②反应在4min~5min间,平衡向逆方向移动,可能的原因是_________ (单选),表中5min~6min之间数值发生变化,可能的原因是_________ (单选)
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)已知:CO(g)+H2O(g)![]() H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数/K | 9.94 | 9 | 1 |
C(s)+CO2(g)![]() 2CO(g) K
2CO(g) K
C(s)+H2O(g)![]() CO(g)+H2(g) K1
CO(g)+H2(g) K1
CO(g)+H2O(g)![]() H2(g)+CO2(g) K2
H2(g)+CO2(g) K2
则K、K1、K2之间的关系是K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项是关于玻璃棒在若干实验中的用途及操作,其中不正确的是( )
A.溶解物质时搅拌
B.蘸取少量溶液做焰色试验
C.过滤时向漏斗中转移液体
D.配制一定物质的量浓度的溶液时引流
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10 mol/L NaOH溶液分别滴定20.00 mL浓度均为0.10 mol/L的CH3COOH 溶液和HCN溶液所得滴定曲线如图所示。下列说法正确的是
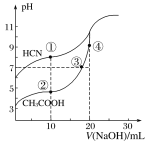
A. 室温下,电离平衡常数:K(HCN)>K(CH3COOH)
B. 点①和点②所示溶液中:c(CH3COO-)>c(CN-)
C. 点③所示的溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
D. 点④所示的溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com