
【题目】(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g) +H2O(g) ![]() CO2(g) +H2 (g) △H<0,t℃时物质浓度(mol·L-1)的变化CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=_________mol·L-1·min-1。
CO2(g) +H2 (g) △H<0,t℃时物质浓度(mol·L-1)的变化CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=_________mol·L-1·min-1。
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c4 |
4 | c1 | c2 | c3 | c4 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |

(2)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min~4min之间反应处于_________状态; c 1数值_________0.08 mol·L-1 (填大于、小于或等于)
②反应在4min~5min间,平衡向逆方向移动,可能的原因是_________ (单选),表中5min~6min之间数值发生变化,可能的原因是_________ (单选)
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)已知:CO(g)+H2O(g)![]() H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数/K | 9.94 | 9 | 1 |
C(s)+CO2(g)![]() 2CO(g) K
2CO(g) K
C(s)+H2O(g)![]() CO(g)+H2(g) K1
CO(g)+H2(g) K1
CO(g)+H2O(g)![]() H2(g)+CO2(g) K2
H2(g)+CO2(g) K2
则K、K1、K2之间的关系是K=________。
【答案】0.03 平衡 大于 d a K1/K2
【解析】
(1)则0~4min的平均反应速率v(CO)=(0.20-0.08)/4=0.03mol·L-1·min-1;综上所述,本题答案是:0.03。
(2)由t℃>850℃,温度升高,化学反应速率加快,达到化学平衡状态所需时间缩短,故①表中3-4 min之间反应已处于平衡状态,又由于所给反应为放热反应,温度升高平衡向逆反应方向移动,所以c1值大于0.08 mol·L-1;综上所述,本题答案是:平衡,大于。
②对于已达平衡状态的气体总体积不变的放热反应,若平衡向逆反应方向移动,可能的原因只有可能减少反应物或增大了生成物的浓度,d选项正确;由表中数据可知在5-6 min之间c(H2O)增大,而c(CO)减小,c(CO2)增大,故发生这种变化的原因只可能为增大了水蒸气的用量,a选项正确;综上所述,本题答案是:d ,a。
(3)将K2对应方程式倒过来,H2(g)+CO2(g) ![]() CO(g)+H2O(g),K3=1/K2=c(CO)c(H2O)/ c(H2)c(CO2);C(s)+H2O(g)
CO(g)+H2O(g),K3=1/K2=c(CO)c(H2O)/ c(H2)c(CO2);C(s)+H2O(g)![]() CO(g)+H2(g) K1=c(H2)c(CO)/c(H2O);C(s)+CO2(g)
CO(g)+H2(g) K1=c(H2)c(CO)/c(H2O);C(s)+CO2(g)![]() 2CO(g) K= c2(CO)/ c(CO2);所以K= K3×K1= K1/K2;综上所述,本题答案是:K1/K2。
2CO(g) K= c2(CO)/ c(CO2);所以K= K3×K1= K1/K2;综上所述,本题答案是:K1/K2。


科目:高中化学 来源: 题型:
【题目】完全燃烧一定质量的无水乙醇,放出的热量为Q,已知为了完全吸收生成的二氧化碳,消耗50mL 8mol/L的氢氧化钠溶液,则无水乙醇的燃烧放出的热量不可能是( )
A. 10Q B. 5Q~10Q C. 大于10Q或小于5Q D. 小于8Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮元素是构成生物体的主要元素,在动植物生命活动中起着重要作用。根据要求回答下列问题:
(1)氮原子核外有___________种不同运动状态的电子,基态氮原子核外电子排布图为___________。
(2)已知:(NH4)2CO3![]() 2NH3↑+H2O↑+CO2↑
2NH3↑+H2O↑+CO2↑
①与氧同周期,且第一电离能比氧大的元素有___________种。
②分解所得的气态化合物分子的键角由小到大的顺序为___________(填化学式)。
(3)物质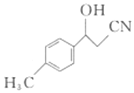 中与CO32-中的碳原子杂化类型相同和不同的碳原子的个数比为___________。
中与CO32-中的碳原子杂化类型相同和不同的碳原子的个数比为___________。
(4)配合物[Cu(CH3C≡N)4]BF4中铜原子的价电子排布式:___________,BF4-的空间构型为___________。写出与BF4-互为等电子体的一种分子和一种离子的化学式:___________、___________。
(5)碳元素与氮元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4个碳原子位于立方体的面心,4个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。
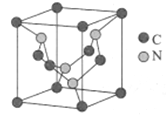
①晶胞中C原子的配位数为___________。该晶体硬度超过金刚石的原因是___________。
②已知该晶胞的边长apm,阿伏加德罗常数用NA表示,则该晶体的密度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍。下说法不正确的是( )
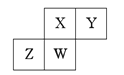
A.原子半径:Z>W>X>Y
B.最简单氢化物的熔沸点:X>Y>W>Z
C.最高价氧化物对应水化物的酸性:X>W>Z
D.化合物XY与ZY2中均含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.05mol/LNaOH溶液分别滴定10.00mL浓度均为0.10 mol/LCH3COOH( Ka=l×10-5)溶液HCN(Ka=5×10-10)溶液,所得滴定曲线如图。下列说法正确的是

A. 对两种弱酸滴定均可选用甲基橙作指示剂
B. ③处溶液有:c(Na+)=c(CH3COO-)<c(CH3COOH)
C. 溶液中水的电离程度:②>③>④
D. 点①和点②溶液混合后:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 白色污染是指橡胶造成的污染
B. 硫和氮的氧化物是形成酸雨的主要物质
C. 汽车尾气的排放是造成温室效应的主要原因
D. 含磷洗涤剂的使用是造成水体富营养化的主要原因
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com