
【题目】某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示. 
(1)X的转化率是
(2)由图中所给数据进行分析,该反应的化学方程为
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)= ,
(4)当反应进行到第min,该反应达到平衡.
(5)以下操作能加快该反应速率的是(多选)
a.向该容器中充入一定量的z气体
b.向该容器中充去一定量的He气
c.升高反应的温度
d.降低反应的温度
e.分离出生成的z气体
(6)以下现象能确定反应达到了平衡状态的是(多选)
a.三种气体的浓度之比为3:1:2
b.n(Z)的量不再改变
c.气体的总物质的不变
d.气体的密度不变
e.生成3mol X的同是生成了2mol的Z.
【答案】
(1)30%
(2)3X+Y?2Z
(3)0.05mol?(L?min)﹣1
(4)2
(5)ac
(6)bce
【解析】解:(1)从图中可知X的起始量为1.0mol,2分钟达平衡,X转化了0.3mol,则X的转化率= ![]() ×100%=30%,所以答案是:30%;
×100%=30%,所以答案是:30%;
(2.)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,
且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y2Z,所以答案是:3X+Y2Z;
(3.)v(Z)= ![]() =
= ![]() =0.05mol(Lmin)﹣1 , 所以答案是:0.05mol(Lmin)﹣1;
=0.05mol(Lmin)﹣1 , 所以答案是:0.05mol(Lmin)﹣1;
(4.)2min时,各物质的量不再变化,达到平衡,
所以答案是:2;
(5.)加快该反应速率的方法有升温、增大反应物的浓度、增大压强、使用催化剂等,
a.向该容器中充入一定量的z气体,容器体积不变,增大了生成物浓度,逆反应速率加快,正反应速率随之也会加快,故a正确;
b.向该容器中充去一定量的He气,容器体积不变,各物质的浓度不变,对反应速率无影响,故b错误;
c.升高反应的温度,速率加快,故c正确;
d.降低反应的温度,速率减慢,故d错误;
e.分离出生成的z气体,生成物浓度减小,逆反应速率减小,正反应速率随之也会减小,故e错误;
所以答案是:ac;
(6.)在一定条件下,当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,
a.达平衡时是各物质浓度保持不变,不是成比例,三种气体的浓度之比为3:1:2时不一定达到平衡,故a错误;
b.n(Z)的量不再改变,物质的量不再变化说明已达平衡,故b正确;
c.从方程式可知这是一个气体总物质的量在减小的反应,当气体的总物质的量不变时,说明各物质的量不变,达到平衡,故c正确;
d.容器的体积不变,根据质量守恒,气体的总质量也不变,气体的密度始终不变,不能说明达到平衡,故d错误;
e.生成3mol X的方向是逆方向,生成了2mol的Z的方向是正方向,方向相反,且X与Z的变化量之比等于其计量数之比,说明正反应速率与逆反应速率相等,则达到平衡,故e正确;
所以答案是:bce.
【考点精析】关于本题考查的化学平衡状态本质及特征和化学平衡状态的判断,需要了解化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等才能得出正确答案.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】中药狼把草全草浸剂给动物注射,有镇静、降压及轻度增大心跳振幅的作用。有机物M是中药狼把草的成分之一,其结构如图所示。下列叙述不正确的是( )

A. M是芳香族化合物,它的分子式为C9H5O4Cl
B. 1 mol M最多能与含2 mol Br2的溴水发生反应
C. 1 mol M分别与足量的NaOH溶液、Na2CO3溶液反应,消耗两种物质的物质的量分别为4 mol、2mol
D. 在一定条件下能发生取代、加成、水解、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中有0.2mol XO4-,加入0.3mol Na2SO3恰好反应,已知Na2SO3被氧化成Na2SO4,则还原产物中X的化合价为
A. +1 B. +3 C. +4 D. 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属腐蚀及防护的表述正确的是
A.金属腐蚀的本质:金属失电子发生还原反应
B.牺牲阳极的阴极保护法:被保护的金属应做负极
C.外加电流阴极保护法:被保护的金属应与电源正极相连
D.生铁投入NH4Cl溶液中:主要发生析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是
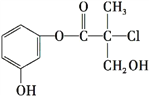
A. 该有机物与溴水发生加成反应
B. 该有机物经催化氧化后能发生银镜反应
C. 该有机物与浓硫酸混合加热可发生消去反应
D. 1 mol该有机物与足量NaOH溶液反应最多消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。

已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。请回答下列问题:
(1)图中E的大小对该反应的反应热________(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点___________ (填“升高”还是“降低”)。
(2)完成SO2氧化为SO3的热化学方程式______________________________________。
(3)铝元素在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一而加以控制。铝及其化合物在下列场合使用时必须严格加以控制的是________(填字母)
A.用明矾净水 B.制电线电缆 C.制包糖果用的铝箔 D.制防锈油漆
(4)铝在空气中会被氧化生成一层致密的氧化膜(氧化物)而对铝起保护作用,但这层氧化膜(氧化物)遇到强酸或强碱都会溶解,请写出氧化膜与氢氧化钠溶液反应的化学方程式:_____________________

(5)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O可制H2,其物质转化如图所示。写出其中氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含1 mol复盐NH4Al(SO4)2液中加入Ba(OH)2溶液,若生成l.6 mol BaSO4沉淀,则生成NH3H2O的物质的量为
A.0.8molB.l molC.0.2molD.0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学生小陈在实验中不小心将碘水沾在白色实验服上,下面哪种物质的水溶液不能够除掉实验服上的碘水斑迹( )
A.维生素CB.双氧水C.Na2SO3D.SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com