
【题目】溶液中有0.2mol XO4-,加入0.3mol Na2SO3恰好反应,已知Na2SO3被氧化成Na2SO4,则还原产物中X的化合价为
A. +1 B. +3 C. +4 D. 0
科目:高中化学 来源: 题型:
【题目】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的离子方程式有:;
(2)硫酸铜溶液可以加快氢气生成速率的原因是;
(3)要加快上述实验中气体产生的速率,还可采取的措施有(答两种);
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
实验 | A | B | C | D | E | F |
4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V3= , V8=;
②反应一段时间后,实验A中的金属呈色,实验E中的金属呈色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因 .
④实验A测得:收集到产生H2体积为112mL(标准状况下)时所需的时间为10分钟,求化学反应速率ν(H2SO4)=(忽略反应前后溶液体积变化).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况可能引起大气污染的是( )
①煤的燃烧 ②工业废气任意排放 ③燃放鞭炮 ④飞机、汽车尾气的排放
A. 只有①② B. 只有②④ C. 只有①②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氯化氢的摩尔质量为36.5g
B. 1molH2SO4的质量为98g.mol-1
C. 任何物质的摩尔质量都等于他的相对分子质量或相对原子质量
D. CO2的摩尔质量是H2的摩尔质量的22倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)写出实验室制备氨气的化学方程式:______________________________ ;氨的水溶液显弱碱性,其原因为__________________________(用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”) ;若加入少量的明矾,溶液中的NH的浓度________(填“增大”或“减小”) 。
(2)硝酸铵加热分解可得到N2O和H2O。250 ℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为________________________________,平衡常数表达式为________;若有1 mol硝酸铵完全分解,转移的电子数为________mol。
(3)将pH=12的氨水和pH=2的盐酸等体积混合后溶液呈______性。
(4)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1 mol N2,其ΔH=________kJ·mol-1。
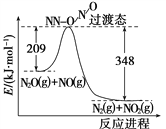
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示. 
(1)X的转化率是
(2)由图中所给数据进行分析,该反应的化学方程为
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)= ,
(4)当反应进行到第min,该反应达到平衡.
(5)以下操作能加快该反应速率的是(多选)
a.向该容器中充入一定量的z气体
b.向该容器中充去一定量的He气
c.升高反应的温度
d.降低反应的温度
e.分离出生成的z气体
(6)以下现象能确定反应达到了平衡状态的是(多选)
a.三种气体的浓度之比为3:1:2
b.n(Z)的量不再改变
c.气体的总物质的不变
d.气体的密度不变
e.生成3mol X的同是生成了2mol的Z.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A. 在多电子的原子里,能量高的电子通常在离核近的区域内活动
B. 核外电子总是先排在能量高的电子层上,由里向外逐层排布
C. 两种微粒,若核外电子排布完全相同,则其化学性质不一定相同
D. 微粒的最外层只能是8个电子才稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com