
【题目】氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)写出实验室制备氨气的化学方程式:______________________________ ;氨的水溶液显弱碱性,其原因为__________________________(用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”) ;若加入少量的明矾,溶液中的NH的浓度________(填“增大”或“减小”) 。
(2)硝酸铵加热分解可得到N2O和H2O。250 ℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为________________________________,平衡常数表达式为________;若有1 mol硝酸铵完全分解,转移的电子数为________mol。
(3)将pH=12的氨水和pH=2的盐酸等体积混合后溶液呈______性。
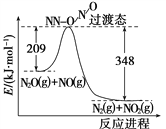
(4)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1 mol N2,其ΔH=________kJ·mol-1。
【答案】 2NH4Cl+Ca(OH)2 ![]() 2NH3+CaCl2+2H2O NH3·H2O
2NH3+CaCl2+2H2O NH3·H2O ![]() NH4++OH- 降低 增大 NH4NO3
NH4++OH- 降低 增大 NH4NO3 ![]() N2O↑+2H2O c(N2O)×c2(H2O) 4 碱 -139
N2O↑+2H2O c(N2O)×c2(H2O) 4 碱 -139
【解析】(1)实验室用氯化铵和氢氧化钙加热反应制备氨气,反应的化学方程式为2NH4Cl+Ca(OH)2 ![]() 2NH3+CaCl2+2H2O;一水合氨为弱碱,在水溶液中存在部分电离,电离出氢氧根离子使溶液显碱性,方程式为:NH3H2O
2NH3+CaCl2+2H2O;一水合氨为弱碱,在水溶液中存在部分电离,电离出氢氧根离子使溶液显碱性,方程式为:NH3H2O![]() NH4++OH-,向氨水中加入少量NH4Cl固体,c(NH4+)增大,平衡左移,即c(OH-)减小,pH值降低,加入少量明矾,明矾电离出的铝离子结合氢氧根生成氢氧化铝,促进氨水的电离,c(NH4+)增大,故答案为:2NH4Cl+Ca(OH)2
NH4++OH-,向氨水中加入少量NH4Cl固体,c(NH4+)增大,平衡左移,即c(OH-)减小,pH值降低,加入少量明矾,明矾电离出的铝离子结合氢氧根生成氢氧化铝,促进氨水的电离,c(NH4+)增大,故答案为:2NH4Cl+Ca(OH)2 ![]() 2NH3+CaCl2+2H2O;NH3H2O
2NH3+CaCl2+2H2O;NH3H2O![]() NH4++OH-;降低;增大;
NH4++OH-;降低;增大;
(2)硝酸铵分解生成N2O和H2O,达到平衡,说明为可逆反应,化学反应方程式为:NH4NO3![]() N2O+2H2O,250℃时,水为气体状态,故平衡常数K=c(N2O)×c2(H2O),NH4NO3中NH4+的N元素化合价为-3价,NO3-中的N元素的化合价为+5价,反应后N元素的化合价为+1价,发生归中反应,N元素由-3价升高到+1价,升高了4,因此反应中每分解1mol硝酸铵,转移电子数为4mol,故答案为:NH4NO3
N2O+2H2O,250℃时,水为气体状态,故平衡常数K=c(N2O)×c2(H2O),NH4NO3中NH4+的N元素化合价为-3价,NO3-中的N元素的化合价为+5价,反应后N元素的化合价为+1价,发生归中反应,N元素由-3价升高到+1价,升高了4,因此反应中每分解1mol硝酸铵,转移电子数为4mol,故答案为:NH4NO3![]() N2O+2H2O;K=c(N2O)×c2(H2O);4;
N2O+2H2O;K=c(N2O)×c2(H2O);4;
(3)pH=12的氨水的浓度大于0.01mol/L,pH=2的盐酸的浓度等于0.01mol/L,等体积混合后氨水过量,溶液呈碱性,故答案为:碱;
(4)由图可知,此反应反应物总能量高于生成物,且△H=209-348=-139kJmol-1,故答案为:-139。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】如表为元素周期表的一部分,请参照元素①﹣⑧在表中的位置,用化学用语回答下列问题: 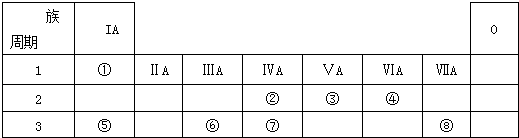
(1)④、⑤、⑥的原子半径由大到小的顺序为 .
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: .
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) .
a.MnO2b.FeCl3c.Na2SO3d.KMnO4
(5)由表中元素形成的常见物质X,Y,Z,M,N可发生以下反应: 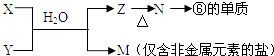
X溶液与Y溶液反应的离子方程式为 , N→⑥的单质的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(6分)煤等化石燃料燃烧时产生的SO2 会对大气造成污染。如果某火力发电厂每秒燃烧10kg煤,煤中硫元素的质量分数为1%。假设煤中的硫全部转化为SO2,试计算该发电厂每天产生SO2的物质的量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 氯气是黄绿色的,氯离子是无色的
B. 氢气在氯气中燃烧时发出苍白色火焰
C. 新制氯水可使蓝色石蕊试纸先变红后褪色
D. 漂白粉在空气中容易变质的原因是Ca(ClO)2见光易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中A~J分别代表相关反应的一种物质.已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出.请填写以下空白: 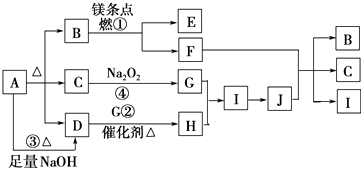
(1)A中含有的化学键是 .
(2)写出铜与J反应制取H的化学方程式:
(3)写出反应③的离子方程式: .
(4)写出物质B的电子式:;写出物质E的电子式: .
(5)在反应④中,当生成标况下22.4L 物质G时,转移电子数为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中有0.2mol XO4-,加入0.3mol Na2SO3恰好反应,已知Na2SO3被氧化成Na2SO4,则还原产物中X的化合价为
A. +1 B. +3 C. +4 D. 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烷烃和一气态烯烃组成的混合气体在同温、同压下对氢气的相对密度为13,取标准状况下此混合气体4.48L,通入足量的溴水,溴水质量增加2.8g,此两种烃的组成为(填分子式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是
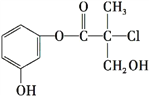
A. 该有机物与溴水发生加成反应
B. 该有机物经催化氧化后能发生银镜反应
C. 该有机物与浓硫酸混合加热可发生消去反应
D. 1 mol该有机物与足量NaOH溶液反应最多消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于摩尔质量叙述中正确的是( )
A. 1 mol CO 的质量是 28 g·mol-1 B. 硫酸根离子的摩尔质量是 98 g
C. Cl2 的摩尔质量是 71 g·mol D. NaCl 的相对分子质量是 58.5 g·m
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com