
【题目】如表为元素周期表的一部分,请参照元素①﹣⑧在表中的位置,用化学用语回答下列问题: 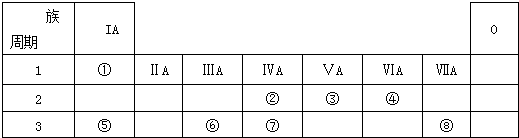
(1)④、⑤、⑥的原子半径由大到小的顺序为 .
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: .
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) .
a.MnO2b.FeCl3c.Na2SO3d.KMnO4
(5)由表中元素形成的常见物质X,Y,Z,M,N可发生以下反应: 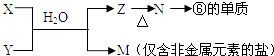
X溶液与Y溶液反应的离子方程式为 , N→⑥的单质的化学方程式为 .
【答案】
(1)Na>Al>O
(2)HNO3>H2CO3>H2SiO3
(3)![]()
(4)ab
(5)Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;2Al2O3  4Al+3O2↑
4Al+3O2↑
【解析】解:由元素在周期表中的位置、可知①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl.
(1.)电子层越多半径越大,所以Na、Al>O,电子层一样多的原子,核电荷数越多半径越小,即Na>Al,所以答案是:Na>Al>O;
(2.)②③是C、N,是同一周期元素的原子,根据元素周期律:从左到右最高价氧化物对应水化物的酸性逐渐增强,所以酸性:HNO3>H2CO3 , ②⑦是C、Si,是同主族元素,根据元素周期律:从上到下最高价氧化物对应水化物的酸性逐渐减弱,H2CO3>H2SiO3 , 所以答案是:HNO3>H2CO3>H2SiO3;
(3.)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,符合条件的有NaOH、NaClO、NaClO3等,NaOH的电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;
;
(4.)两种元素的原子按1:1组成的常见液态化合物为H2O2 , 在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,不能用作催化剂,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,也不能作催化剂,
所以答案是:ab;
(5.)由表中元素形成的常见物质X、Y、Z、M、N可发生如图转化的反应,其中M是仅含非金属的盐,所以一定是铵盐;Z ![]() N→⑥的单质;根据周期表的结构判断⑥是金属铝,所以推断N是氧化铝电解生成金属铝,Z是氢氧化铝受热分解生成氧化铝,由产物及X+Y+H2O→Al(OH)3+NH4+可知该反应是铝盐和一水合氨的反应,所以X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O=Al(OH)3↓+3NH4+ , N→⑥的单质的化学方程式为2Al2O3
N→⑥的单质;根据周期表的结构判断⑥是金属铝,所以推断N是氧化铝电解生成金属铝,Z是氢氧化铝受热分解生成氧化铝,由产物及X+Y+H2O→Al(OH)3+NH4+可知该反应是铝盐和一水合氨的反应,所以X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O=Al(OH)3↓+3NH4+ , N→⑥的单质的化学方程式为2Al2O3  4Al+3O2↑,
4Al+3O2↑,
所以答案是:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;2Al2O3  4Al+3O2↑.
4Al+3O2↑.


科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列叙述中,不正确的是
A.在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大
B.用活性炭为糖浆脱色和用臭氧漂白纸浆,原理不同
C.钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀
D.在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2Fe(SO4)2·6H2O (莫尔盐,浅绿色)是重要的化工原料和化学试剂。某课题小组为了探究莫尔盐的分解产物,开展了如下实验:
(1)甲组同学猜想:莫尔盐的分解产物可能是N2、Fe2O3、SO3和H2O四种物质。你是否同意甲组同学的猜想,并说明理由:______________________。
(2)乙组同学按照如下图所示的装置进行实验,关闭止水夹,加热A中的莫尔盐固体至分解完全,检验其分解产物。

①装置B的仪器名称是______________,所盛试剂是_________________。
②装置C中可观察到的现象是________________, 由此可知硫酸亚铁铵分解的产物中有___________。
(3)丙组同学选用乙组实验中的装置A和下图所示的装置,进行实验验证莫尔盐分解的产物中还有SO2和SO3。

①丙组同学的实验装置中,依次连接的合理顺序为A______________(用装置字母表示)。取适量固体于A中,通入 N2一段时间后,关闭止水夹,冉点燃酒精灯。通入N2的目的是___________________ 。
②若装置H中有白色沉淀生成,则证明分解产物中有__________________;能证明分解产物中有SO2的实验现象是___________________ 。
(4)丁组同学将一定量的莫尔盐在500℃的隔绝空气加热—段时间后,检验其固体产物。设计实验证明,此固体产物不含二价铁:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1 mol CO2的质量为44g/mol B. 3.01×1023个SO3的质量为80g
C. 标准状况下,1 mol任何气体体积都约为22.4L D. C2H4的摩尔质量为28g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物能 ⑦风能 ⑧氢能
A. ①②③④ B. ⑤⑥⑦⑧ C. ③⑤⑦ D. ③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的离子方程式有:;
(2)硫酸铜溶液可以加快氢气生成速率的原因是;
(3)要加快上述实验中气体产生的速率,还可采取的措施有(答两种);
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
实验 | A | B | C | D | E | F |
4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V3= , V8=;
②反应一段时间后,实验A中的金属呈色,实验E中的金属呈色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因 .
④实验A测得:收集到产生H2体积为112mL(标准状况下)时所需的时间为10分钟,求化学反应速率ν(H2SO4)=(忽略反应前后溶液体积变化).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的比较中,正确的是
①沸点:H2O>HCl>HF ②密度:四氯化碳>水>汽油
③酸性:H3PO4>H2SO4>HClO4④离子半径:O2->F->Na+
A.①③B.②④C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)写出实验室制备氨气的化学方程式:______________________________ ;氨的水溶液显弱碱性,其原因为__________________________(用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”) ;若加入少量的明矾,溶液中的NH的浓度________(填“增大”或“减小”) 。
(2)硝酸铵加热分解可得到N2O和H2O。250 ℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为________________________________,平衡常数表达式为________;若有1 mol硝酸铵完全分解,转移的电子数为________mol。
(3)将pH=12的氨水和pH=2的盐酸等体积混合后溶液呈______性。
(4)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1 mol N2,其ΔH=________kJ·mol-1。
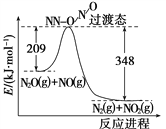
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com