
分析 氯化铁溶解铜生成氯化亚铁和氯化铜,反应后溶液溶液中加入铁粉,剩余固体质量小于Fe粉的质量,则溶解Cu后溶液中还有剩余的FeCl3,加入铁粉先发生:2Fe3++Fe=3Fe2+,然后发生:Fe+Cu2+=Fe2++Cu,最终有固体剩余,则Fe3+完全反应,溶液中含有溶质FeCl2,假设反应后溶液中没有CuCl2,根据氯离子守恒可知溶液中FeCl2为$\frac{0.8L×3mol/L×3}{2}$=3.6mol,则加入的Fe应为3.6mol-0.8L×3mol/L=1.2mol,而实际加入Fe为$\frac{56g}{56g/mol}$=1mol<1.2mol,故溶液中一定含有CuCl2,根据Fe原子守恒计算溶液n(FeCl2),再根据氯离子守恒计算n(CuCl2),进而计算溶液中各溶质浓度.
解答 解:氯化铁溶解铜生成氯化亚铁和氯化铜,反应后溶液溶液中加入铁粉,剩余固体质量小于Fe粉的质量,则溶解Cu后溶液中还有剩余的FeCl3,加入铁粉先发生:2Fe3++Fe=3Fe2+,然后发生:Fe+Cu2+=Fe2++Cu,最终有固体剩余,则Fe3+完全反应,溶液中含有溶质FeCl2,假设反应后溶液中没有CuCl2,根据氯离子守恒可知溶液中FeCl2为$\frac{0.8L×3mol/L×3}{2}$=3.6mol,则加入的Fe应为3.6mol-0.8L×3mol/L=1.2mol,而实际加入Fe为$\frac{56g}{56g/mol}$=1mol<1.2mol,故溶液中一定含有CuCl2,
根据Fe原子守恒,溶液n(FeCl2)=n(FeCl3)+n(Fe)=0.8L×3mol/L+1mol=3.4mol,则溶液c(FeCl2)=$\frac{3.4mol}{0.8L}$=4.25mol/L,
根据氯离子守恒,n(CuCl2)=$\frac{1}{2}$×(0.8L×3mol/L×3-3.4mol×2)=0.2mol,则溶液c(CuCl2)=$\frac{0.2mol}{0.8L}$=0.25mol/L,
答:最终所得溶液中FeCl2为4.25mol/L、CuCl2为0.25mol/L.
点评 本题考查混合物有关计算,关键是利用假设法判断溶液中溶质,侧重考查学生分析计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 钾与水反应时增大水的用量 | |
| B. | 铝与稀硫酸反应制取氢气时,改用浓硫酸 | |
| C. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| D. | 实验室制取二氧化碳时,将块状大理石改为粉状大理石 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
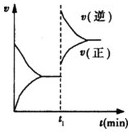
| A. | t1时,一定是缩小了容器的体积 | |
| B. | t1时,可能是向容器中通入了一定量的C气体 | |
| C. | t1时改变外界条件后,该反应的平衡常数可能减小,也可能不变 | |
| D. | t1时,可能是向容器中加入了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
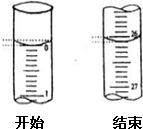 某学生欲用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL)] | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | |||
| 第二次 | 25.00 | 1.56 | 28.08 | 26.52 |
| 第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 氢键X-H…Y | 键能kJ.mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
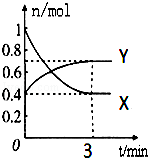 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com