
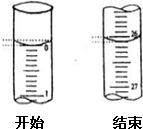
 某学生欲用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL)] | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | |||
| 第二次 | 25.00 | 1.56 | 28.08 | 26.52 |
| 第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
分析 (1)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化;
(2)根据滴定管的使用方法,正确的操作方法分析,见解答;
(3)根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析不当操作对V(标准)×的影响,以此判断浓度的误差;
(4)依据图示读取滴定前后刻度值;
(5)根据盐酸和NaOH反应求出C(NaOH先根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸),接着根据盐酸和NaOH反应求出C(NaOH).
解答 解:(1)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化,滴定终点时溶液颜色由黄色突变为橙色,且半分钟内不褪色,
故答案为:锥形瓶中溶液颜色的变化;因加入一滴标准液而使溶液由红色变为无色并在30s内不恢复;
(2)A.滴定管主要用来精确地放出一定体积的溶液,故正确;
B.强氧化性溶液腐蚀碱式滴定管的橡皮管,不能用碱式滴定管,故错误;
C.滴定管润洗的方法是关闭活塞,从上口注入适量的溶液,顺时针转动滴定管,再从下口将液体放入废液杯中,故错误;
D.排出碱式滴定管尖嘴部分气泡的方法是轻轻挤开玻璃珠,产生一条缝,让气泡连同液体一起在重力的作用下赶走,故错误;
E.本实验中待测的氢氧化钠溶液需用碱式滴定管量取,故错误;
故答案为:A;
(3)A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析,测定c(NaOH)偏大,故A不符合;
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析可知,测定c(NaOH)无影响,故B不符合;
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析可知,测定c(NaOH)偏大,故C不符合;
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×c(标准)}{V(待测)}$分析可知,测定c(NaOH)偏低,故D符合;
故答案为:D;
(4)起始读数为0.00mL,终点读数为26.10mL,
故答案为:26.10;
(5)根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸)=26.09mL,
HCl+NaOH=NaCl+H2O
0.02609L×0.1000mol/L 0.025L×C(NaOH)
则C(NaOH)=$\frac{0.02609L×0.1000mol/L}{0.025L}$=0.1044mol/L;
故答案为:0.1044mol/L.
点评 本题主要考查了中和滴定操作、误差分析以及计算,难度不大,理解中和滴定的原理是解题关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | HX为弱酸,且电离平衡常数Ka≈1×10-10 | |
| B. | 水的电离程度:M点大于N点 | |
| C. | P点c(Cl-)=0.05mol•L-1. | |
| D. | M点c(HX)-c(X-)>c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
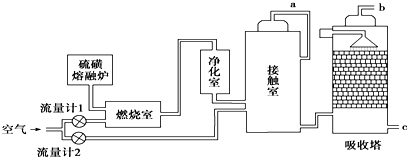
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
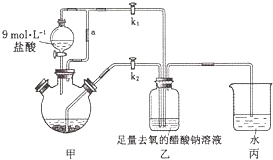
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
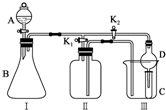

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时溶液中的H+向负极移动 | |
| B. | 在放电时,正极发生的反应是 Pb(s)+SO42-(aq)=PbSO4(s)+2e- | |
| C. | 在放电时,该电池的负极材料是铅板 | |
| D. | 放电时负极反应:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com