
| A. | 氯水的漂白作用 | B. | 氯水呈黄绿色 | ||
| C. | 氯水与NaOH反应 | D. | 氯水与锌反应产生H2 |
分析 能说明氯气与水的反应是可逆反应的事实:改变外界因素,可以引起化学平衡的移动即可,据氯水中的成分以及性质来回答.
解答 解:A、氯水的漂白作用是因为其中含有次氯酸,和氯气与水的反应是可逆反应无关,故A错误;
B、氯水呈黄绿色说明其中含有部分氯气分子,说明氯气和水的反应是可逆的,故B正确;
C、氯水与NaOH反应的原因可以是氯水中的盐酸、次氯酸和氢氧化钠之间的反应,与氯气和水的反应是可逆的之间没有关系,故C错误;
D、氯水与锌反应产生氢气是因为氯水中含有盐酸、次氯酸的缘故,和氯气和水的反应是可逆的之间没有关系,故D错误;
故选B.
点评 本题考查学生可逆反应的化学平衡移动原理以及物质的成分和性质的关系知识,属于基本知识的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 35Cl原子所含质子数为18 | |
| B. | $\frac{1}{18}$mol的1H35Cl分子所含中子数约为6.02×1023 | |
| C. | 3.5g35Cl2气体的体积约为1.12L | |
| D. | 35Cl2气体的摩尔质量为70 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
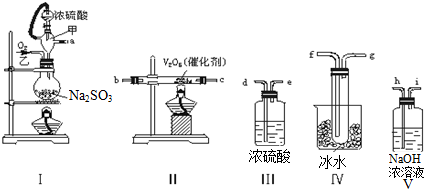
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | HX为弱酸,且电离平衡常数Ka≈1×10-10 | |
| B. | 水的电离程度:M点大于N点 | |
| C. | P点c(Cl-)=0.05mol•L-1. | |
| D. | M点c(HX)-c(X-)>c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中NH4+、S2-、Fe3+、K+可以大量共存 | |
| B. | 与NaHCO3溶液的反应为Al3++3HCO3-═Al(OH)3↓+3CO2↑ | |
| C. | 通入过量的氨气,最终看不到沉淀 | |
| D. | 与Ba(OH)2反应使SO42-沉淀完全的离子方程式为2Al3++6OH-+3SO42-+3Ba2+═2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
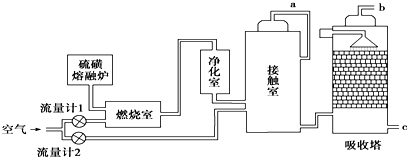
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
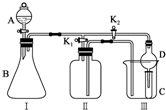

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com