
分析 (1)从元素最高价氧化物对应水合物的酸碱性强弱规律思考;
(2)同周期元素从左到右元素单质氧化性逐渐增强;
(3)从元素单质氧化性强弱规律和简单离子还原性规律分析.
解答 解:(1)根据同主族元素从上到下元素最高价氧化物对应水合物的酸性逐渐减弱,可知:酸性H3PO4<HNO3;同一周期,原子序数越大,非金属性越强,可知:酸性:H2SO4<HClO4;故答案为:<;<;
(2)根据同周期元素从左到右元素单质氧化性逐渐增强,可知:氧化性Cl2>S;同一周期,原子序数越大,非金属性越强,故非金属性:N2<O2,
故答案为:>;<;
(3)同一主族,金属性随着原子序数递增,逐渐增强,故碱性KOH>NaOH,同一周期,金属性随着原子序数递增,金属性逐渐减弱,故碱性:Mg(OH)2>Al(OH)3,故答案为:>;>.
点评 本题考查了元素周期律的理解与应用,注意把握元素周期律的递变规律以及相关知识的积累,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
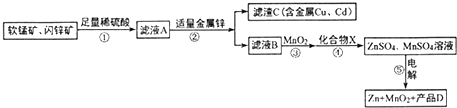
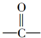 与HCN反应引入:
与HCN反应引入: $→_{一定条件}^{HCN}$
$→_{一定条件}^{HCN}$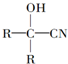
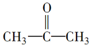 $→_{一定条件①}^{HCN}$A$\underset{\stackrel{{H}_{2}O,{H}^{+}}{→}}{②}$B$→_{③}^{浓H_{2}SO_{4},△}$C$→_{催化剂④}^{聚合}$D
$→_{一定条件①}^{HCN}$A$\underset{\stackrel{{H}_{2}O,{H}^{+}}{→}}{②}$B$→_{③}^{浓H_{2}SO_{4},△}$C$→_{催化剂④}^{聚合}$D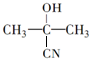 ,D
,D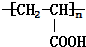 .
.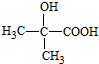 $→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.
$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.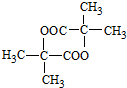 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
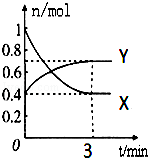 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 或
或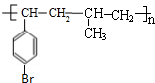 .
.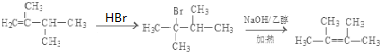 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,改变了反应的途径,反应放出的热量也一定发生变化 | |
| B. | 改变压强,平衡不发生移动,反应放出的热量不变 | |
| C. | 升高温度,反应速率加快,反应放出的热量不变 | |
| D. | 若在原电池中进行,反应放出的热量不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com