
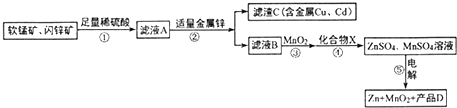
分析 软锰矿:MnO2含量≥65%;Al2O3含量为4%.闪锌矿:ZnS含量≥80%;FeS、CuS、CdS含量各为2%,软锰矿、闪锌矿与硫酸溶液共热时可析出硫,滤液A为硫酸铁、硫酸锰、硫酸铝、硫酸铜、硫酸镉的水溶液,加入适量金属锌,锌和铁离子反应生成锌离子和亚铁离子,锌和铜离子反应生成铜和锌离子,滤液B中含金属离子:Zn2+、Mn2+、Fe2+、Al3+,过滤得到滤渣为铜、镉,滤液B中加入二氧化锰氧化亚铁离子为铁离子,加入化合物X后可得纯净的ZnSO4、MnSO4溶液,X可以是ZnO或Zn(OH)2,Mn(OH)2或MnCO3,电解ZnSO4、MnSO4溶液得到锌、二氧化锰和D为硫酸,
(1)MnO2和FeS在酸溶液中发生氧化还原反应生成硫单质、硫酸锰、硫酸铁和水,结合电荷守恒和原子守恒配平书写离子方程式;
(2)代替二氧化锰氧化亚铁离子不能引入难易除去的杂质;
(3)电解过程中MnO2应在阳极生成,因Mn元素失去电子;
(4)电解ZnSO4、MnSO4溶液得到锌、二氧化锰和D为硫酸;
(5)①趁热过滤防止高锰酸钾析出;
②向绿色溶液中通入适量CO2后,将溶液加热,并趁热滤去残渣含MnO2(s)将滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得紫色KMnO4晶体 生成产物为二氧化锰、高锰酸钾和碳酸钾;
③二氧化碳过量会生成溶解度小的碳酸氢钾随高锰酸钾晶体析出混入杂质.
解答 解:软锰矿:MnO2含量≥65%;Al2O3含量为4%.闪锌矿:ZnS含量≥80%;FeS、CuS、CdS含量各为2%,软锰矿、闪锌矿与硫酸溶液共热时可析出硫,滤液A为硫酸铁、硫酸锰、硫酸铝、硫酸铜、硫酸镉的水溶液,加入适量金属锌,锌和铁离子反应生成锌离子和亚铁离子,锌和铜离子反应生成铜和锌离子,滤液B中含金属离子:Zn2+、Mn2+、Fe2+、Al3+,过滤得到滤渣为铜、镉,滤液B中加入二氧化锰氧化亚铁离子为铁离子,加入化合物X后可得纯净的ZnSO4、MnSO4溶液,X可以是ZnO或Zn(OH)2,Mn(OH)2或MnCO3,电解ZnSO4、MnSO4溶液得到锌、二氧化锰和D为硫酸,
(1)MnO2和FeS在酸溶液中发生氧化还原反应生成硫单质、硫酸锰、硫酸铁和水,结合电荷守恒和原子守恒配平书写离子方程式为:3MnO2+2FeS+12H+$\frac{\underline{\;\;△\;\;}}{\;}$2Fe3++3Mn2++2S+6H2O,
故答案为:3MnO2+2FeS+12H+$\frac{\underline{\;\;△\;\;}}{\;}$2Fe3++3Mn2++2S+6H2O;
(2)代替二氧化锰氧化亚铁离子不能引入难易除去的杂质,
A.KMnO4固体会氧化亚铁离子,但会引入钾离子,故A不符合;
B.H2O2 可以氧化亚铁离子,且不引入新的杂质,故B符合;
C.浓硝酸会氧化亚铁离子,但会引入硝酸根离子,故C不符合;
D.新制氯水可以氧化亚铁离子,但会引入氯离子,故D不符合;
故答案为:B;
(3)因Mn元素失去电子,可知步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+,
故答案为:Mn2+-2e-+2H2O=MnO2+4H+;
(4)加入化合物X后可得纯净的ZnSO4、MnSO4溶液,X可以是ZnO或Zn(OH)2,Mn(OH)2或MnCO3,硫酸根离子不变,且生成氢离子,可知产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用,
故答案为:H2SO4;
(5)①趁热过滤防止高锰酸钾析出,第Ⅲ步操作中“趁热过滤”的目的是防止温度降低,KMnO4晶体析出导致产率下降,
故答案为:防止温度降低,KMnO4晶体析出导致产率下降;
②向绿色溶液中通入适量CO2后,将溶液加热,并趁热滤去残渣含MnO2(s)将滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得紫色KMnO4晶体 生成产物为二氧化锰、高锰酸钾和碳酸钾,反应的化学方程式为:2CO2+3K2MnO4$\frac{\underline{\;\;△\;\;}}{\;}$2KMnO4+MnO2↓+2K2CO3,
故答案为:2CO2+3K2MnO4$\frac{\underline{\;\;△\;\;}}{\;}$2KMnO4+MnO2↓+2K2CO3;
③二氧化碳过量会生成溶解度小的碳酸氢钾随高锰酸钾晶体析出混入杂质,③Ⅲ中需控制CO2的用量,若CO2过量,会使所得产品的纯度降低,原因可能是通入过量CO2会生成溶解度小的KHCO3,随KMnO4晶体一起析出,
故答案为:通入过量CO2会生成溶解度小的KHCO3,随KMnO4晶体一起析出.
点评 本题考了物质分离提纯的实验过程分析,主要是离子性质、离子分离、离子检验、电解池原理和电极反应书写,掌握基础是解题关键,题目难度中等.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫及其化合物具有广泛的用途.回答下列问题:
硫及其化合物具有广泛的用途.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com